揭开“寒武纪物种大爆发”的神秘面纱
你是否曾经思考过,我们人类的机体为何如此精密复杂,却又能如此协调统一?哪怕像心脏瓣膜那般小巧的生理结构,对个体生存来说都是必不可少的。随着分子生物学的长期发展,今天我们越来越清楚哪些生化反应和分子机制保障了神经、免疫、消化等各种复杂生理系统的正常运行。我们对于自身的认知看似正朝着越来越清晰的方向展开。然而,越多精细复杂的分子机制似乎是为“人类是被创造出来的精美造物”这一智能创造论观点提供有力证据。故仅凭分子生物学来解释当前生物的运行机制是远远不够的,要想从根本上把生命科学真正带出不可知论的泥潭,我们必须还要弄清楚我们是如何从最简单的单细胞生物演变成今天的样子。正如著名演化学家杜布赞斯基的经典名言所述,“如果抛开演化,生命科学的一切都只是空中楼阁”(Nothing in biology makes sense except in the light of evolution)。
01. 何谓寒武纪物种大爆发?
自然界的动物千奇百怪,但我们往往会发现许多不同动物拥有某些普遍类似的形态特征。例如,我们人类的大脑、脊椎、四肢、胃肠等多个组织器官至少能在猴子、狗、鸟类、鱼类甚至某些看起来跟我们完全不同的动物中发现功能类似的结构。演化学家们正是根据共享的形态特征来给不同动物进行归类。他们将那些能最大程度地在足够多物种之间找到共性的特征组合定义为躯体构造(body plan)。于是,在特定生命阶段共享同一套body plan的大量物种构成了一个门(Phylum)。按照当前学界的主流观点,演化学家们把现生动物分成了33个门(也有说31个门)。常见的几个动物门主要包括:人类、鸟类、鱼类所在的脊索动物门,昆虫、虾、蟹等所在的节肢动物门,蚯蚓、水蛭所在的环节动物门,章鱼、蜗牛、牡蛎所在的软体动物门,蛔虫、线虫所在的线虫动物门,海星、海胆、海参所在的棘皮动物门,以及水母、珊瑚所在的刺胞动物门。
这里需要强调的是,body plan特征未必会在动物个体的整个生命周期中一直维持下去,经常会只在胚胎发育过程中的特定阶段出现。以我们人类所处的脊索动物门为例,定义脊索动物门的body plan包括:脊索、咽裂、中空的背神经索、内柱(或甲状腺)和肛后尾,其中脊索结构只在几乎所有脊椎动物的胚胎中出现(在更接近祖先状态的文昌鱼体内终身保持),而四足动物(即陆生脊椎动物)的咽裂也只发生在其胚胎期。正因为对动物演化有了更清晰的认知,我们在过去的脊椎动物门基础上添加了头索动物(文昌鱼等)和背囊动物(海鞘等),定义出了脊索动物门(此时把脊椎动物归为一个亚门结构)。19世纪早期,作为发育生物学鼻祖之一的冯·贝尔发现了“动物越早期的胚胎往往持有着代表更大类群的共性特征”等一系列规律,因此分析比较不同物种的胚胎发育过程是研究动物演化的重要手段之一。
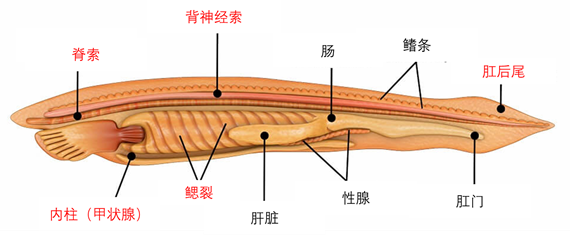
图一 脊索动物门的body plan(标为红色),
图源:https://biologydictionary.net/vertebrate/
门是动物界的下一级的分类单元,每个门高度保守的body plan特征在该门的最晚共同祖先阶段就已经建立了。也就是说,我们最远能在多久以前的地质岩层中发现拥有某套body plan特征的生物化石,就意味着我们大概确定其对应的动物门的最早起源阶段。一百多年以来,古生物学家们不断在全球各地的不同年代地层中挖掘动物化石,并通过与现生动物比较形态特征来鉴定它们所在的门类。他们惊奇地发现,几乎所有主要动物门类都在寒武纪早期(距今约5.3~5.5亿年)集中涌现,此后再无新的动物门产生。这个在动物界空前绝后的宏观演化现象被称为“寒武纪物种大爆发”[1](后文中简称为“寒武纪大爆发”)。也有研究认为寒武纪大爆发应该包含更早的埃迪卡拉纪的一部分,前后可能持续了约5000万年[2]。不过不管怎样,如此空前绝后的演化事件相对于地球生物数十亿年的漫长演化历史而言都显得太过短暂而不同寻常。迄今为止最著名的寒武纪化石生物群分别是代表了寒武纪早期的中国云南澄江生物群,以及代表了寒武纪中期的加拿大布尔吉斯页岩生物群。在许多不同的寒武纪生物群中,古生物学家们发现了几乎最原始的不同门类的动物化石,典型的例如最早的节肢动物之一三叶虫、最早的脊索动物云南虫、最早的软体动物内克虾,等等。
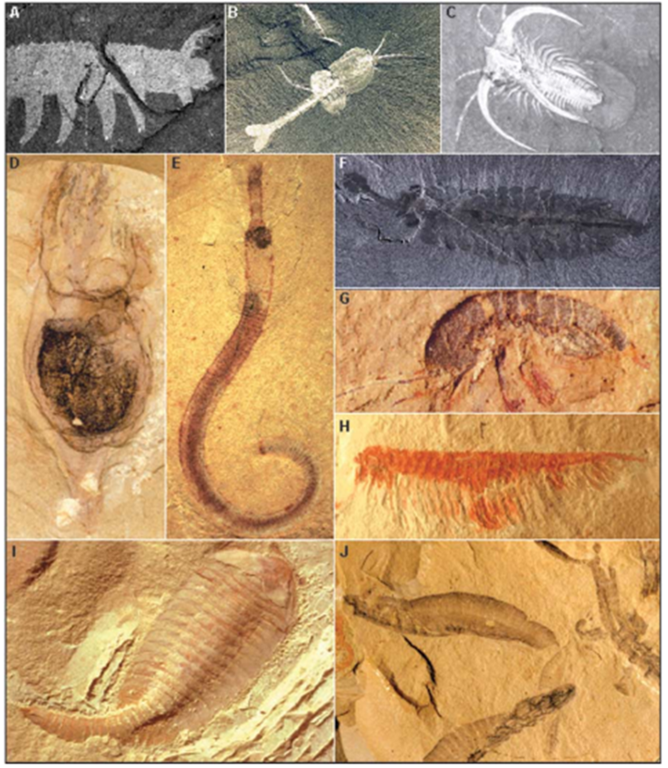
图二 中国云南早寒武世(5.1亿年前)澄江动物群(D至I)和加拿大不列颠哥伦比亚省中寒武世伯吉斯页岩动物群(A至C, J)的寒武纪body plan图例。(A)有爪动物门:埃谢栉蚕;(B)节肢动物门:瓦普塔虾;(C)节肢动物门:马尔拉虫;(D)疑似海鞘:长柄火炬虫;(E)鳃曳动物门:帽天山虫;(F)泛节肢动物:欧巴宾海蝎;(G)节肢动物门:林乔利虫;(H)节肢动物:多节尖峰虫;(I)节肢动物:抚仙湖虫;(J)脊索动物门:海口鱼[3]
02. Evo-devo对性状起源问题的解释
在达尔文所处的时代,化石所展示出的动物多样性几乎是在寒武纪凭空出现的,此前的地层中无法找到连续的祖先,这也成了达尔文一生最大的困惑。虽然此后还有埃迪卡拉纪动物化石(距今约5.4~6.3亿年)被发现,但这些化石的结构十分简单对称,而且很难与任何现生动物的形态特征直接联系起来。因此,寒武纪大爆发至今仍被看作是一个极其特殊且至关重要的宏观演化事件,其产生原因需要得到解释。
大部分假说致力于寻找当时外部环境的特殊性。例如,有些人认为此前的生物圈以较为简单的单细胞生物为主,而多细胞动物的出现使得它们前所未有地快速统治了广泛的生态位,于是获得了空前的演化优势并快速演化。还有些人认为是当时适宜的温度以及较高的氧含量支持多细胞动物能够稳定生存,提供了“物种大爆发”的条件。然而在漫长的演化历程中,适宜而稳定的外部环境经常出现,而且数次物种大灭绝事件后巨大的生态位空缺也同样没有引发全新的动物门出现。事实上,没有任何科学实验能够证明彼时的外部条件与物种大爆发之间存在某种必然联系。总的来说,外部因素远不足以有效解释寒武纪大爆发的发生。
也有人曾这样认为:历史上发生的重大演化事件就像划过长空的流星,我们最多只能记录它的出现,却没法弄清它为什么出现,毕竟我们不能对着几亿年前的生物化石做基因测序或细胞生物学研究。然而在上世纪80年代,一个全新学科的出现改变了这一切,那就是演化发育生物学(evolutionary developmental biology,简称evo-devo)。该领域的科学家们致力于从现生动物胚胎发育的内部因素出发,解释寒武纪大爆发。
首先,evo-devo关注了body plan的特殊性。Rupert Riedl最早提出,之所以body plan特征自出现以后的数亿年保持高度保守,是因为它们扮演着其他大量特征出现的前提条件[4]。例如,神经系统雏形的首次出现使得持有该特征的后代有机会进一步演化出包括大脑在内无比复杂的中枢神经系统。这样,一个全新动物门如何出现的问题就转换成了对应的body plan特征是如何构建出来的。
从个体的发育过程来看,动物的组织器官都不是受精卵形成之初就已经决定好了的,而是在胚胎发育过程中逐步从无到有地分化出来的。分化出来的不同细胞类型未来会发育成不同的器官,因此这些器官发育的最初始细胞类型被称为器官原基。于是,body plan等保守特征的起源问题又进一步转化为探寻远古祖先为何获得一系列最基本的细胞分化能力的问题。Evo-devo将这种带来全新胚胎发育能力的不连续演化过程叫做演化创新(evolutionary innovation)[5]。
Eric Davidson进一步指出,胚胎发育过程中,某些具有调控功能的蛋白可以激活包括自身在内的大量基因选择性表达,这些调控关系形成了驱动细胞发生分化的基因调控网络(gene regulatory network,GRN)。网络中那些高度保守的核心调控关系在演化过程中首次构建通过形成某种前所未有的细胞分化能力,从而导致一个全新的body plan特征出现[3]。因此,evo-devo的主要研究方式就是通过在不同现有物种的胚胎中比较发育调控机制的异同,来弄清body plan等保守形态特征的演化起源问题,且由此得到的结论可以在模式生物中验证真伪。寒武纪大爆发就是涉及了一系列演化创新事件的复杂演化过程,至今尚未完全研究清楚,但最近十几年的研究已经取得了一系列颠覆性的重大成果。
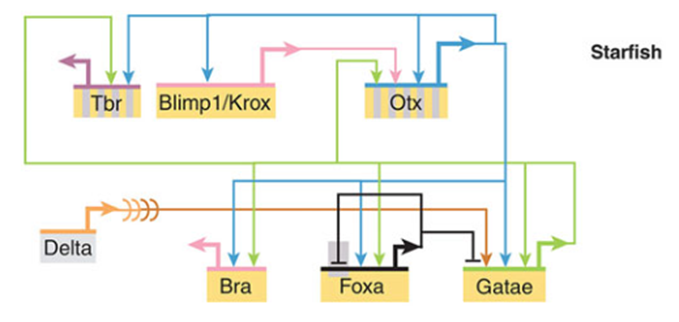
图三 海星的中胚层GRN核心:Notch信号蛋白结合Delta受体后,依次激活Foxa等几个上游转录因子在中胚层区域特异性表达,由此驱动中胚层细胞分化。
03. 刺胞动物是破解大爆发之谜的关键
在现存的33个门中,其中有29个门的动物整体上呈现出左右对称的形态特征,它们共同构成了两侧对称动物(Bilaterian)。另外四个门按照跟两侧对称动物的关系由远及近分别是,栉板动物门(栉水母),多孔动物门(海绵等动物),扁盘动物门(黏丝盘虫),以及刺胞动物门(水母,海葵,珊瑚等动物)(注:虽然海星等棘皮动物看起来是轴对称而非两侧对称,但它的胚胎是两侧对称的,发育模式才是决定物种门类划分的根本依据)。其中刺胞动物被认为是距两侧对称动物最近的姊妹群。寒武纪大爆发恰好对应着那些两侧对称动物门祖先出现的时间点,而两侧对称动物祖先和刺胞动物祖先的分离则大约发生在更早的埃迪卡拉纪前期,距今约6亿年[6]。于是一开始人们曾简单地认为只要弄清楚有两侧对称动物共有的发育模式如何起源就足以充分解释寒武纪大爆发。

图四 根据最新一系列分子生物学结果划分的动物门类系统发生树[7]
自上世纪80年代以来,人们在小鼠和果蝇的早期胚胎中发现它们基于高度类似的发育调控网络实现最初的细胞分化。这其中包括体轴和胚层的形成,Hox基因按体节排布顺序以共线性的方式表达,转录因子PAX6诱导眼睛早期分化,NK-2驱动心脏分化等多个发育过程。于是,人们默认是两侧对称动物共同祖先Urbilaterian构建了一系列最基础的相关发育能力并拿到了向更复杂方向演化的“通行证”。然而,当人们对海葵等刺胞动物的基因组检查后发现:两侧对称动物的那些发育调控基因居然在刺胞动物中几乎都能找到同源基因,但在更远的海绵或栉水母中则很少找到同源基因。这说明搭建一个复杂动物所需的发育调控基因,至少在刺胞动物和两侧对称动物共同祖先阶段就已经基本准备齐全了[8]。而当人们研究刺胞动物如何使用这些基因来完成胚胎发育的时候,竟然震撼地发现不同门类的两侧对称动物共有的那些发育调控机制几乎全都能在刺胞动物中找到!
04. 三胚层模式的起源
这一切还要从一个特殊的胚胎组织谈起:胚孔。当受精后的早期胚胎经历一定次数的有丝分裂之后,其表面特定位置会出现一道细细的裂纹,名叫胚孔。接下来发生的事情可以说是地球上最神奇的生命现象。我们以爪蟾为例[9],位于胚胎“南半球”的细胞从胚孔处不断陷入胚胎内部,并不断向内延伸,成为内胚层;而“北半球”的细胞从另一侧包围过来,直到将“南半球”彻底“吃”进去,形成包裹着整个胚胎的外胚层。在内、外胚层的相向运动过程中,它们之间需要一种特殊的“润滑剂”来抵消彼此接触带来的黏附摩擦,最终实现“我吃我自己”。于是,在内外胚层之间的复杂相互诱导下,它们接触面上的那些原本像“固体”一样稳定的上皮细胞转化为像“液体”一样流动的间充质细胞(该过程被称为上皮间充质转化),这样就形成了夹在内、外胚层之间的中胚层。陷入胚孔的内胚层细胞并不会填满整个胚胎,而是形成一个会在未来发育成消化系统的空腔(原肠腔),故此时胚胎叫被做原肠胚。
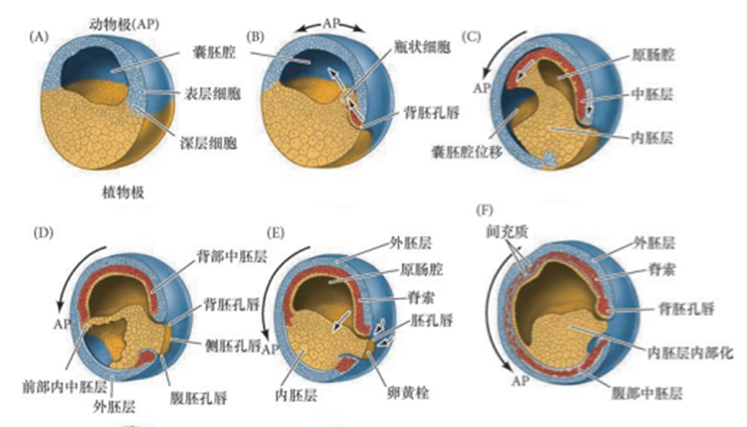
图五 (A-F)爪蟾原肠胚形成过程。经过多次有丝分裂之后,囊胚期胚胎的南北半球分界处形成裂缝(胚孔),然后“南半球”(植物极,黄色)从胚孔腹侧内陷形成内胚层,“北半球”(动物极,蓝色)外包过来形成外胚层,在二者夹层间形成中胚层(红色),由胚孔向内扩出的腔即时原肠腔。图源:发育生物学(原书第11版)
原肠胚的三个胚层分别会分化出不同的组织器官:外胚层发育成神经和表皮系统,中胚层发育出肌肉和循环系统,内胚层主要负责消化系统的发育。这套发育模式对所有两侧对称动物都是通用的,三胚层原肠胚是两侧对称动物最核心的保守发育特征之一,因此被喻为“是你生命中最重要的时刻”。两侧对称动物根据胚孔发育出来口或肛门而被区分为原口动物和后口动物两大类,前者包含节肢动物、环节动物等大部分门,后者仅有棘皮动物、半索动物和脊索动物三个门。
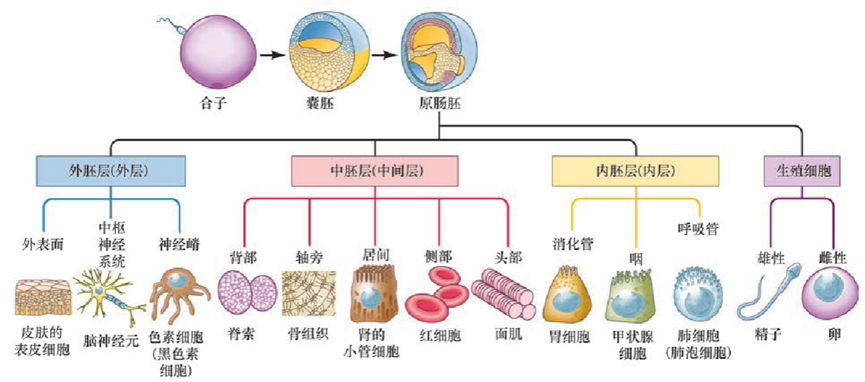
图六 从受精卵发育到有三个胚层的原肠胚,每个胚层都产生无数的分化细胞类型。图源:发育生物学(原书第11版)
相比而言,刺胞动物同样把胚孔发育为口,但它们的原肠胚只有外、内两个胚层。其中外胚层的模式与两侧对称动物类似,而发育成消化腔的内胚层过去则被认为对应着两侧对称动物内胚层和中胚层的混合体,因此也被称为中-内胚层(endomesoderm),作为两个独立胚层的潜在演化前体。然而最新的研究表明,两侧对称动物的三个胚层都能在刺胞动物中找到对应结构[10]。从基因表达层面来看,作为刺胞动物的代表,星状海葵(Nematostella vectensis)的内胚层几乎完美对应着两侧对称动物的中胚层,而两侧对称动物内胚层基因则集中表达在其咽部外胚层区域。而从生物学功能来看,由海葵的咽部外胚层发育出来的消化腔隔膜丝表达了胰岛素样肽等消化酶基因,与发育自两侧对称动物内胚层的胰腺等组织高度一致。也就是说,曾被认为是两侧对称动物最基础特征的三胚层模式并非最初起源自两侧对称动物祖先,而是其与刺胞动物门的共同祖先。

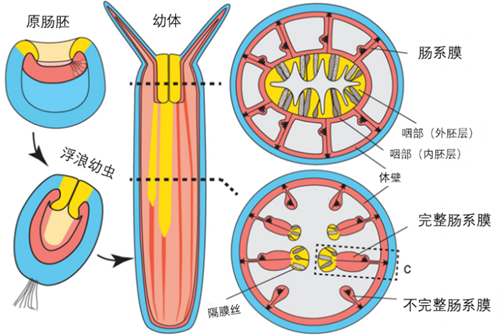
图七 左:两种观点下,两侧对称动物与刺胞动物的胚层对应关系。右:海葵胚胎发育的解剖示意图(颜色与左图对应)。其中咽部外胚层发育为肠系膜最外侧的隔膜丝,该结构通过分泌消化酶来起到消化食物的作用
05. 体轴与体节的起源
BMP信号梯度:腹背轴的起源
汉斯·施佩曼在对爪蟾胚胎的进一步研究中发现,位于其胚孔背侧边缘的细胞(胚孔背唇)扮演着整个胚胎发育过程的信号中心,其一旦被移除剩余的胚胎就只能发育出的模糊不清的组织,而将其贴到另一爪蟾胚胎的胚胎腹部则会诱导其发育出拥有两套完整的头和躯干的“连体儿”蝌蚪。施佩曼将这个初始的发育信号中心命名为胚胎发育的“组织者”细胞,他也因此获得1936年诺贝尔奖[11]。组织者细胞能够诱导最初的神经系统从外胚层中分化出来,失去它们也就意味着其外胚层彻底“腹化”为完全没有神经的表皮组织。由胚孔背侧指向腹侧的腹背轴建立标志着原肠胚开始形成,一系列轰轰烈烈的细胞分化事件从此展开。

图八 施佩曼将一个爪蟾胚胎的胚孔背唇贴到另一个蝾螈胚胎腹侧,于是前者无法发育,而后者发育出有两套完整躯体的“连体儿”蝌蚪。因此胚孔背唇被施佩曼称为“组织者”细胞
事实上,无论是两侧对称动物还是刺胞动物,腹背轴的建立都意味着神经系统的发生(刺胞动物称为指示轴,从口腔周围的一侧指向其对侧),它们都是由BMP信号通路导致的。BMP信号在原肠胚初期的外胚层中会起到抑制神经系统发生的功能并弥散分布于胚胎中。此时,来自胚胎腹或背侧的组织中心分泌拮抗BMP的信号就会在其附近去除BMP对神经发生的抑制,让神经系统从这里开始发育[12]。决定外胚层分化为神经和表皮两部分的腹背轴就是由从组织者细胞到胚孔对侧的BMP信号现梯度分布决定的。
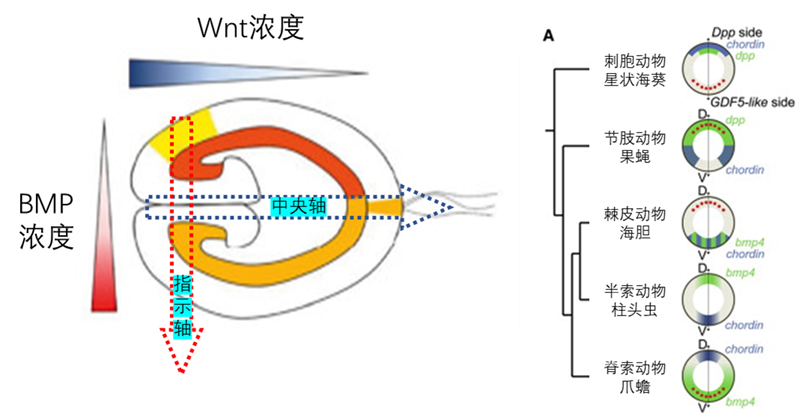
图九 左:海葵胚胎的体轴。中央轴由Wnt浓度梯度决定,从口指向肠腔。指示轴由BMP浓度梯度决定,垂直于中央轴,由抗BMP信号中心(组织者细胞,淡黄色区域)指向胚孔的对侧。右:刺胞动物的指示轴与两侧对称动物的腹背轴同源,都是由对BMP信号(BMP4或dpp,绿色区域)的拮抗(Chordin,蓝色区域)决定
Wnt信号梯度:前后轴的起源
那两侧对称动物共有的第二条体轴——前后轴该怎么解释呢?它对应着海葵的中央轴(由口部穿过其消化腔的主轴),由Wnt信号浓度梯度决定。海葵胚胎的外胚层沿着中央轴呈现出鲜明分布的基因表达特征,它们编码了两套最基本的神经系统:位于胚孔周围的胚孔神经系统(BNS),以及相对位于消化腔尽头的顶侧的顶端神经系统(ANS)。这套由Wnt信号梯度编码的调控网络,在两侧对称动物的前后轴部署了相同结构[13]。于是Arendt等人提出了这样一个假说:两侧对称动物的胚孔沿着前后轴拉长(例如脊椎动物细长的原条结构),使得BNS与ANS交汇,形成了同时控制感知与运动的中枢神经系统(CNS)[14]。
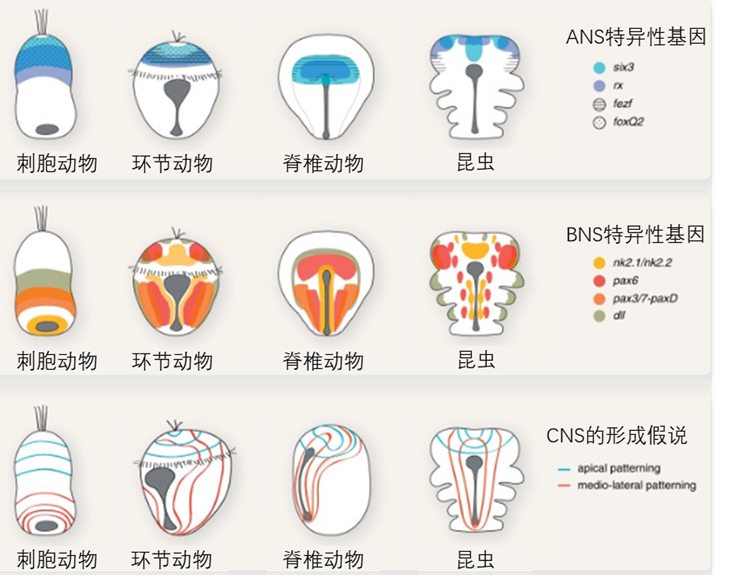
图十 Wnt信号浓度梯度在两侧对称动物前后轴或刺胞动物中央轴的分布,编码了控制运动神经的BNS与控制感知的ANS,二者交汇形成了两侧对称动物的CNS
Hox共线性:体节的起源
有没有证据证明胚孔的拉长呢?那就是著名的Hox共线性。在海葵等刺胞动物中,Gbx基因和3个Hox基因在胚孔外周交错表达,而在两侧对称动物中,它们的同源基因以相同方式沿前后轴分布在胚孔两侧的中胚层区域。当海葵的Hox基因被依次敲除后,其表达区域对应的一对小室就与周围小室发生了融合,这与它们在两侧对称动物中胚层调控体节分化的过程高度类似[15]。也就是说,海葵的消化腔分隔和两侧对称动物体节分节的过程应该起源自共同祖先建立的古老发育模式,拉长的胚孔使原本分布在其周围的Hox基因在部署到两侧对称动物的前后轴[16]。有所不同的是,在刺胞动物中,Hox基因遵循着由BMP信号激活表达的古老调控模式(对应着两侧对称动物的腹背轴),而两侧对称动物祖先则将Hox基因的上游驱动模式改为控制前后轴的Wnt信号[17]。(注:“胚孔拉长”假说与体节同源性在学术前沿尚处于未被完全证实的争议状态,其中一些关键细节的深入研究对理解动物基础发育能力的起源至关重要)
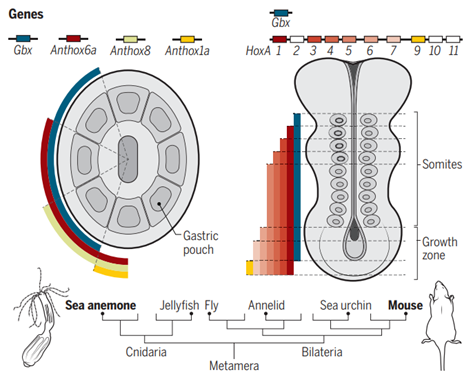
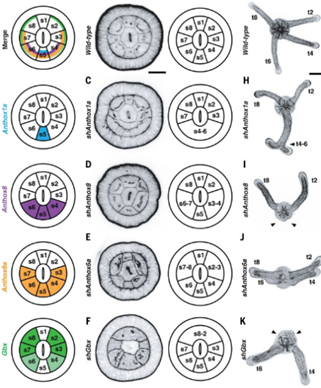
图十一 左:在刺胞动物和两侧对称动物中,Gbx与多个Hox基因呈现出高度一致的共线性表达的特征。右:在海葵中,依次敲除四个相关基因发生了胃囊小室的融合现象,这与两侧对称动物由Hox调控体节形成同源
总之,两侧对称动物共有的一系列基本发育特征在刺胞动物身上几乎都找得到,在过去看来这似乎不可思议。由此可见,发育规律在解释动物门级别以上的宏观演化过程中起主导作用,而适应性演化在微观演化中至关重要,这就像物理学中有长短程力之分:宇观尺度下扭曲时空的引力和原子核尺度下禁锢夸克的强相互作用。故我们不应该因生物之复杂就放弃思考无数表象背后驱动其出现的更深层规律,而应该将不同领域的生物学概念整合统一,在未来构建出足以解释生物多样性与复杂性产生的完善理论体系。它需要像物理学基础理论那样,既简洁优雅,又包罗万象。
正如已知的所有物理规律本质上都衍生于对称性,这样的生命理论的最基本逻辑就是同源性(homology):正是各种层面无处不在的同源性将多姿多态的地球生物紧密联系起来,而不是以完全无序的方式任意变化。那些分子,细胞,遗传,发育,神经等方方面面的生物机制和规律都是遵循它们的生物演化自同一个祖先群体的有力证据,进而凝聚出整个生命科学领域最核心的假说——“生命只在地球上出现过一次”!虽然时常有趋同演化出现,但在总体大方向上生物演化仍被基于同源性的规律所牢牢支配,即无非是基于已有同源特征的渐变(descents with modification)或全新同源模式的产生(evolutionary innovation)。Evo-devo对此最大贡献就在于将生物同源性的概念从最初的基因序列层面,拓展到它们的表达模式,然后是细胞分化,直到最终的表型层面。
06. 总结与展望
综上所述,寒武纪大爆发不只是两侧对称动物的事情,而是至少应该追溯到两侧对称—刺胞动物的共同祖先来考虑它。越来越多的古生物学家正在和发育生物学家在这一点上达成共识。我国在该领域的权威专家,舒德干院士提出了著名的“三幕式寒武纪大爆发”假说,主张只有分别考察刺胞动物,原口动物和后口动物如何依次出现,才能基本将寒武纪大爆发的谜题解释清楚。
目前,evo-devo已经整体上把“第一幕”涉及到的演化创新机制基本解释清晰了,而想彻底解释清楚这一世纪谜题,还需要未来在“后两幕”的研究中更加努力。相信在正确思想的指引下,我们一定会在不远的将来征服这座名为“寒武纪大爆发”的巍峨高山,探寻复杂动物演化的更深层奥秘。
07. 鸣谢
感谢B站网友“Meth_aq”,“迷雾幻境里的梦龙”等多位志同道合的伙伴在交流讨论中带来的启发,尤其感谢哈佛大学何朔南博士的卓越工作和无私帮助激发了笔者对刺胞动物原肠胚发育的浓厚兴趣。特在此赋诗一首作为结尾,并勉励诸君。
五律·重演
(孙仲夷)
远航寒武纪,始于刺胞门。
三胚造脏腑,两轴定神魂。
万虫起沧海,千演化智人。
纷繁溯何处,须探原肠痕。
参考文献
[1] New York Chichester, West Sussex: Columbia University Press, 2000.
[2] WOOD R, LIU A G, BOWYER F, et al. Integrated records of environmental change and evolution challenge the Cambrian Explosion [J]. Nature Ecology & Evolution, 2019, 3(4): 528-38.
[3] DAVIDSON E H, ERWIN D H. Gene regulatory networks and the evolution of animal body plans [J]. Science, 2006, 311(5762): 796-800.
[4] RIEDL R. A Systems-Analytical Approach to Macro-Evolutionary Phenomena [J]. The Quarterly Review of Biology, 1977, 52(4): 351-70.
[5] MULLER G B, WAGNER G P. Novelty in evolution: restructuring the concept [J]. Annual review of ecology and systematics, 1991, 22(1): 229-56.
[6] PUTNAM N H, SRIVASTAVA M, HELLSTEN U, et al. Sea anemone genome reveals ancestral eumetazoan gene repertoire and genomic organization [J]. Science, 2007, 317(5834): 86-94.
[7] MARTíN-DURáN J M, VELLUTINI B C. Introduction: Young Approaches to Animal Evolution [M]//MARTíN-DURáN J M, VELLUTINI B C. Old Questions and Young Approaches to Animal Evolution. Cham; Springer International Publishing. 2019: 1-12.
[8] CARROLL S B. Evo-Devo and an Expanding Evolutionary Synthesis: A Genetic Theory of Morphological Evolution [J]. Cell, 2008, 134(1): 25-36.
[9] GILBERT S F, BARRESI M J F. Developmental Biology [M]. Sinauer Associates, Incorporated, 2016.
[10] STEINMETZ P R H, AMAN A, KRAUS J E M, et al. Gut-like ectodermal tissue in a sea anemone challenges germ layer homology [J]. Nat Ecol Evol, 2017, 1(10): 1535-42.
[11] CARROLL S B. Endless forms most beautiful: The new science of evo devo and the making of the animal kingdom [M]. WW Norton & Company, 2005.
[12] GENIKHOVICH G, FRIED P, PRüNSTER M M, et al. Axis Patterning by BMPs: Cnidarian Network Reveals Evolutionary Constraints [J]. Cell Rep, 2015, 10(10): 1646-54.
[13] LEBEDEVA T, AMAN A J, GRAF T, et al. Cnidarian-bilaterian comparison reveals the ancestral regulatory logic of the β-catenin dependent axial patterning [J]. Nature Communications, 2021, 12(1): 4032.
[14] TOSCHES M A, ARENDT D. The bilaterian forebrain: an evolutionary chimaera [J]. Current Opinion in Neurobiology, 2013, 23(6): 1080-9.
[15] HE S, DEL VISO F, CHEN C Y, et al. An axial Hox code controls tissue segmentation and body patterning in Nematostella vectensis [J]. Science, 2018, 361(6409): 1377-80.
[16] ARENDT D. Hox genes and body segmentation [J]. Science, 2018, 361(6409): 1310-1.
[17] HOLSTEIN T W. The role of cnidarian developmental biology in unraveling axis formation and Wnt signaling [J]. Developmental Biology, 2022, 487: 74-98.










