不只是雌雄:性别的起源和流动
01 丰富的性别定义:生理性别(Sex)与社会性别(Gender)
在传统意义上,人们对于性别的区分只有两种,即生理性别(Sex)为男或女。在当今社会,性别已经成为一个更加复杂和多样化的概念。人们对于性别的理解不止停留在生物性征,进而衍生出社会性别(Gender)这一更为弹性与复杂的社会学建构。2014年,社交媒体平台Facebook通过性别研究组织GLAAD制定了56种性别可供选择。截止至2023年,全球范围已经出现了107种社会性别分类,其中不仅包括人们熟知的LGBT、酷儿、无性别(Agender),还包括两性人(Androgyne)、顺性人(Cis)、性别流动(Gender Fluid)、泛性别(Pangender)等非传统性别[1]。

32种社会性别符号,图片来源caaloba-d81ds6u
02 动植物中的性别
让我们回到传统定义的生理性别,自然界中的生物并不仅仅局限于固定不变的雌雄二分,而是存在着更为多样和复杂的性别类型。在哺乳动物中,性别一般是由XX(♀)和XY(♂)性染色体决定的,而鸟类性别一般由ZW(♀)和ZZ(♂)性染色体决定,这两套遗传性别决定系统同样广泛存在于其他的动植物中。我们较为熟知的动物大都为雌雄异体(dioecy or gonochorism),雌雄生殖器官分别出现在不同的个体中,每个个体在其一生中仅以一种性繁殖角色存在[2]。且雌雄个体会显示出明显的性二态性(sexual dimorphism)[3-4](即同一物种不同性别之间的差别),比如雌雄之间的体型大小差异,器官形态差异以及羽毛颜色的差异等等。

动物性二态性示例,图片来源Adams Lab
然而,动物中同样存在“无性别者”,即一个个体内同时拥有雄性和雌性的生殖器官的雌雄同体。事实上,雌雄异体的昆虫在动物中占有很大比例,而除去昆虫后,大约三分之一的动物属于雌雄同体[5]。雌雄同体在无脊椎动物中很常见,例如刺胞动物门的珊瑚、海葵、水螅,软体动物门的蜗牛以及多种蠕虫物种。

雌雄同体刺胞动物门物种以及蜗牛示例
相比之下,大部分植物为雌雄同株,比如一朵花中既有雄蕊也有雌蕊(两性花),或是一棵植株上同时存在雄花和雌花。仅有10%的陆地植物是雌雄异株,而在被子植物(开花植物)中,仅有6%是雌雄异株[6]。

慈姑包含雌雄异株和雌雄同株的不同种群,图片来源Barrett Lab
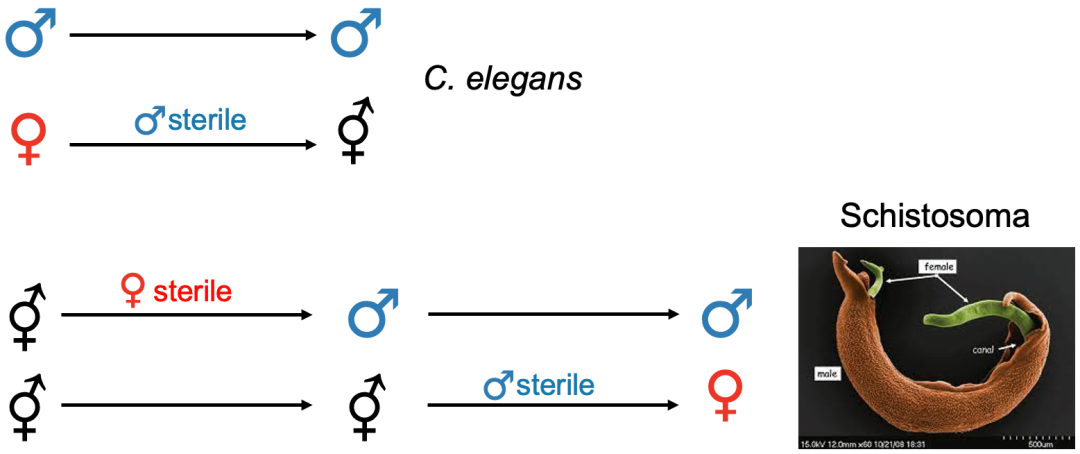
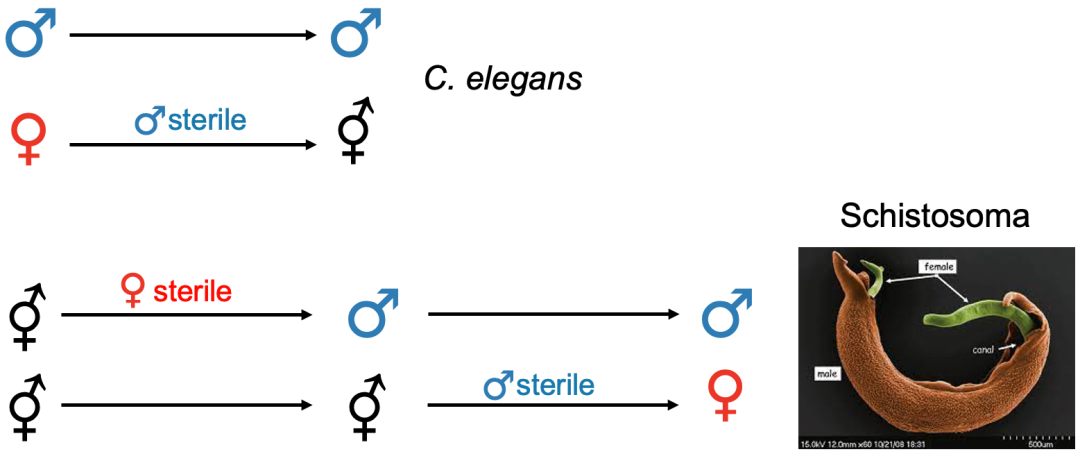
雄性雌雄同体(androdioecy,在植物中称为雄全异株)是指雄性和雌雄同体的个体共存在同一物种种群中,例如我们所熟悉的秀丽隐杆线虫,不过这种性别类型在植物和动物中都很少见。同样,雌性雌雄同体(gynodioecy,在植物中称为雌全异株)是指雌性和雌雄同体个体共存在同一物种种群中,在植物中较为常见。

上为秀丽隐杆线虫,种群中存在雄性和雌雄同体个体;
下为白玉草,种群中存在雌株(雌花植株)以及雌雄同株(两性花植株)
03 性别的起源
性别的起源是生物进化过程中的一个重要事件。相较于无性生殖,有性生殖更复杂,难度更高,但有性生殖通过不同个体间的精卵结合,进行基因交换,使得后代获得更高的遗传多样性,在环境中具有更强的适应能力与生存能力。植物和动物一些分支群中的雌雄同体物种既可以自体受精,也可以选择与其他个体进行异体受精进行有性生殖。雌雄独立性别的从头演化主要基于开花植物中的研究[7-8],因为大部分植物是雌雄同体,并且已有研究估计在被子植物中雌雄异体已经独立发生了数百次演化[9-10]。雌雄同体的独立性别演化至少需要两个突变,首先通过初始突变产生雌性/雄性个体,之后通过第二个突变产生雄性/雌性个体。通过雌全异株的中间状态,在性别类型转换过程中雌性能够完全避免近亲繁殖的压力。相较之下,若雄全异株作为中间状态,雄性个体需要与雌雄同体竞争向胚珠中传递花粉,作为生殖过渡成本更高。这些理论依据有助于解释在植物中观察到的雌全异株的普遍现象。
植物中雌雄同体到雌雄异体的演化“两步”途径,以木瓜和杨树示例
04 性别的流动
性别的演化方向是可逆的,例如在植物中,物种可以从雌雄异体演化为雌雄同体,也可以从雌雄同体演化为雌雄异体。如果在一个种群中,所有的物种都是雌雄同体,那么雌雄同体个体中的雄性和雌性功能应该是平均分配以获得同等的适应度。但如果种群中出现了雌性个体(与雌雄同体相比,其雌性功能占比更高),雌雄同体会通过增加对雄性功能的分配与其他雌雄同体竞争,以将花粉传播至雌性的胚珠;如果资源有限,接着就会降低对雌性功能的分配;进而建立两性群体。在某些情况下,雌雄异体种群中的雌性或者雄性个体都有可能被选择成为雌雄同体个体。例如,当雌雄异体种群迁移至新的生境时,雄性频率的改变(不稳定性)会对种群产生极大的影响。因此,对于雄性个体数量少的种群来说,雌性个体即使只获得少部分的雄性功能,都会产生自体繁殖的优势。在之后的演化过程中若雄性个体完全消失,雌雄同体将分配更多资源在雄性功能上[4]。
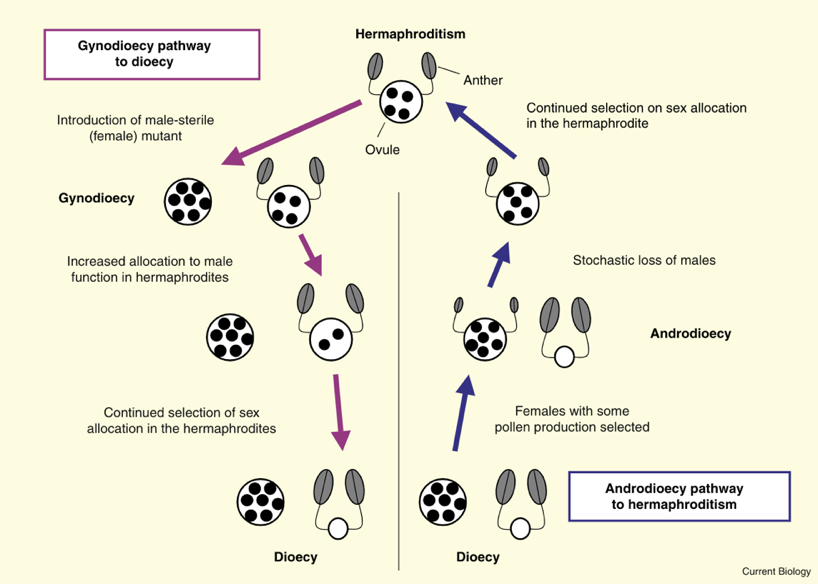
植物中雌雄同体和雌雄异体性别类型转换的常见途径[4]
相较于植物,雌性雌雄同体在动物中极为罕见,到目前为止,只有极少数雌性雌雄同体的动物被报道过(例如脊椎动物盲鳗以及环节动物中的一个物种)[11]。雄性雌雄同体在植物和动物中都很少见,并且通常代表从雌雄异体到雌雄同体的过渡状态(如雄性雌雄同体Caenorhabditis elegans)[11-12]。目前关于动物的性别类型转换案例很少,不同性别类型之间转换的分子机制仍鲜为人知。不过与植物类似,动物从雌雄异体祖先演化为雌雄同体的过程似乎仅限于在雌性个体中进行雌性功能的重新分配;例如雌雄同体取代雌性,与雄性共存。然而动物从雌雄同体转换为雌雄异体的途径中,更倾向于通过雄性雌雄同体作为中间状态,这与植物中的转换途径形成鲜明对比[11]。在动物界中,从雌雄同体祖先到雌雄异体的转变可能涉及性二态性中体积大小的选择。举例来说,几乎所有扁形虫都是雌雄同体的,但血吸虫科中的寄生虫——血吸虫却是个例外。血吸虫不是传统意义上的雌雄异体,雌性血吸虫需要与雄性血吸虫“抱对”后性器官才能发育成熟,并进行交配受精。雄性血吸虫个体体积较大,肌肉更丰富,这增加了它们“抱对”时的紧握和运动能力。而雌性个体则相对较小,受精后能够在血管内准确移动并高效地产卵[13-14]。
血吸虫,图片来源New Frontiers of Molecular Epidemiology of Infectious Diseases
后记
在自然界中,各个生物种群都会选择适合自己的方式,繁衍后代。这些性别类型的存在丰富了生物界的多样性,为不同物种的适应和进化提供了不同的策略和机制,也等待着我们的进一步探索和深入理解。
参考网址以及文献
https://en.wikipedia.org/wiki/Sex%E2%80%93gender_distinction
BAWA K S. Evolution of dioecy in flowering plants [J]. Annual review of ecology and systematics, 1980, 11(1): 15-39.
HEDRICK A V, TEMELES E J. The evolution of sexual dimorphism in animals: hypotheses and tests [J]. Trends Ecol Evol, 1989, 4(5): 136-8.
DELPH L F. Sex allocation: evolution to and from dioecy [J]. Current Biology, 2009, 19(6): R249-R51.
JARNE P, AULD J R. Animals mix it up too: The distribution of self-fertilization among hermaphroditic animals [J]. Evolution, 2006, 60(9): 1816-24.
MING R, BENDAHMANE A, RENNER S S. Sex chromosomes in land plants [J]. Annual review of plant biology, 2011, 62: 485-514.
RENNER S S, MÜLLER N A. Plant sex chromosomes defy evolutionary models of expanding recombination suppression and genetic degeneration [J]. Nat Plants, 2021, 7(4): 392-402.
HENRY I M, AKAGI T, TAO R, et al. One hundred ways to invent the sexes: theoretical and observed paths to dioecy in plants [J]. Annu Rev Plant Biol, 2018, 69: 553-75.
CHARLESWORTH D. Distribution of dioecy and self-incompatibility in angiosperms [M]//GREENWOOD P J, SLATKIN M. Evolution – Essays in Honour of John Maynard Smith. Cambridge; Cambridge University Press. 1985: 237-69.
RENNER S S. The relative and absolute frequencies of angiosperm sexual systems: dioecy, monoecy, gynodioecy, and an updated online database [J]. Am J Bot, 2014, 101(10): 1588-96.
WEEKS S C. The role of androdioecy and gynodioecy in mediating evolutionary transitions between dioecy and hermaphroditism in the Animalia [J]. Evolution, 2012, 66(12): 3670-86.
CHARLESWORTH D. Androdioecy and the evolution of dioecy [J]. Biol J Linn Soc, 1984, 22(4): 333-48.
PLATT T R, BROOKS D R. Evolution of the schistosomes (Digenea: Schistosomatoidea): the origin of dioecy and colonization of the venous system [J]. J Parasitol, 1997, 83(6): 1035-44.
WANG Y, GASSER R B, CHARLESWORTH D, et al. Evolution of sexual systems, sex chromosomes and sex-linked gene transcription in flatworms and roundworms [J]. Nature Communications, 2022, 13(1): 3239.










