鸟类制作华丽羽衣的材料包
鸟类是天生的服装设计大师,有身披华羽的红腹锦鸡,也有一身黑白正装的苦恶鸟。这些五彩缤纷的羽色是如何产生的呢?
书接上回(《用基因组来观鸟》),作为一个观鸟初学者,我只能依靠“以色识鸟”来辨识一些常见鸟类。鸟类体表覆盖的羽毛赋予了它们多样的色彩和图案,这与羽毛的内部结构和色素组成密不可分。羽色可以分为两个大类:结构色和色素色[1, 2]。
【壹】结构色
羽毛表面的凹凸沟纹、羽小枝内的小颗粒、气泡等会通过反射、散射、干涉等方式影响光线的传播,使得鸟类在无需染料的情况下形成了色彩。常见的各种金属光泽就属于这种光学效应,比如蜂鸟、翠鸟、孔雀等。当观察角度变化时,看到的羽色也会随着反射角度的不同而发生改变。
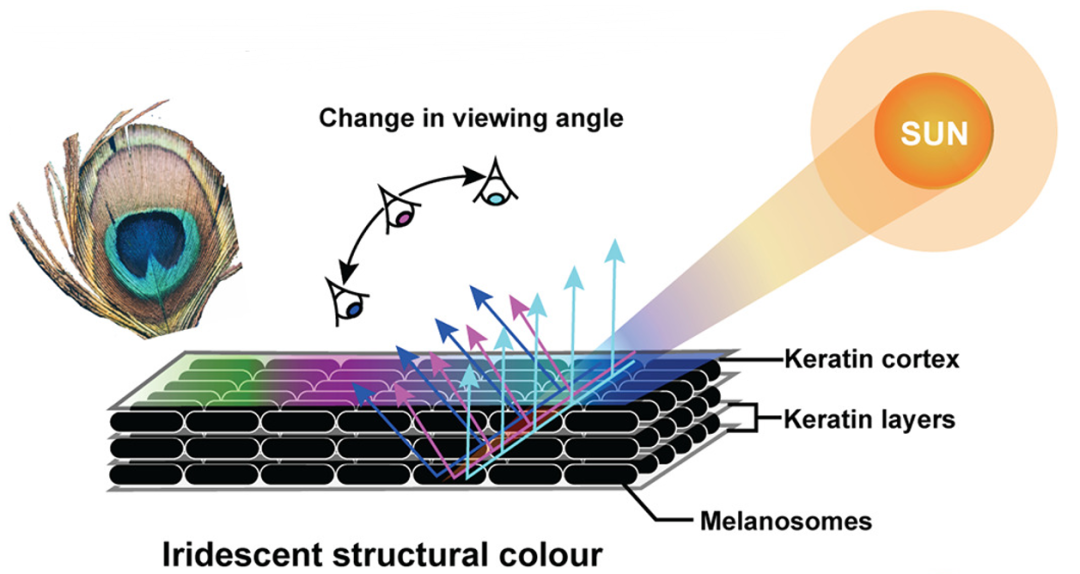
图一. 虹彩羽色,随着观察角度的不同而改变颜色[3]。
但,也有一些羽色不会随着观察角度的变化而变化,被称为非虹彩羽毛(non-iridescent),比如冠蓝鸦(Cyanocitta cristata)的蓝色羽毛。有研究指出,非虹彩蓝色的产生跟海绵状角蛋白层中微小的气孔以及基底黑色素层有关[4]。那不妨思考一下,在哪种特定观测方式下,你可以观察到另外一种颜色的羽毛呢?
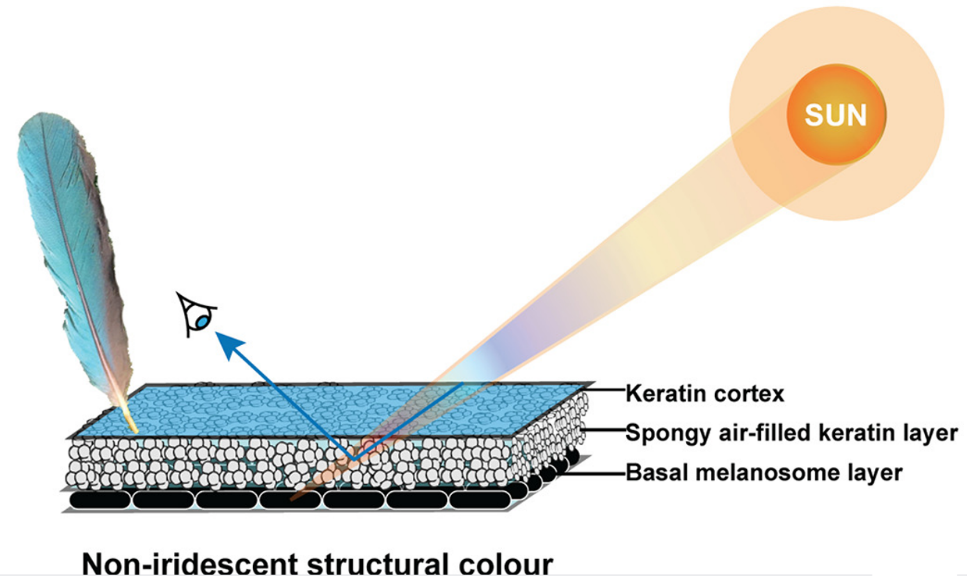
图二. 非虹彩羽色,只将蓝色反射到了我们的眼中[3]。
【贰】色素色
色素是可以吸收和反射特定波长光线的物质,当不同种类和数量的色素存在于羽毛中或附着在羽毛上,就会形成不同的颜色效果。如图三所示,鸟类羽毛主要的色素包括类胡萝卜素(Carotenoids,13.6%)、Psittacofulvins(鹦形目特有,10.6%)、黑色素(Melanins,5.8%)、卟啉色素(Porphyrins,0.5%)、Spheniscins(企鹅目特有的橘黄色)等[1, 3, 5]。
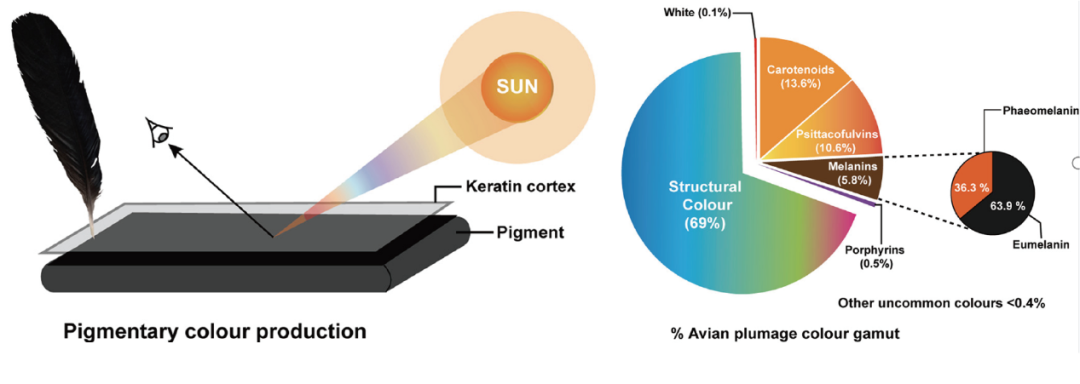
图三. 色素色及不同着色机制的大致比例[3]。

美洲火烈鸟【图片来自ebird】
类胡萝卜素是一种从食物中获取的植物性色素,一些鸟类可以通过特定的酶将其转换为红色色素[6],从而使得羽毛呈现红色、黄色、橙色等颜色。例如,火烈鸟的羽毛色素就是来自于食物中的虾青素。
Psittacofulvins是一种只存在于鹦形目鸟类的特殊色素,可以使羽毛呈现红色、黄色、橙色和绿色等颜色。

鹦鹉【图片来自dbarronoss via Foter.com】
Psittacofulvins是一种只存在于鹦形目鸟类的特殊色素,可以使羽毛呈现红色、黄色、橙色和绿色等颜色。

大雕鸮【图片来自ebird】
黑色素产生的颜色可以从最深的黑色变化到棕色、红褐色、甚至是最浅的淡黄色[7]。这可能是很多设计师都想要拥有的“五彩斑斓的黑”。黑色素在形成斑点、条形等图案方面也起着至关重要的作用。
与羽毛颜色有关的卟啉色素可以分为三类。a) 天然卟啉色素只存在于猫头鹰、大鸨和夜鹰,形成铁锈色羽毛。b) 血液中的血红素。c) 蕉鹃红色和绿色羽毛中特有的卟啉色素[3, 8, 9]。

红冠蕉鹃【图片来自ebird】
Psittacofulvins是一种只存在于鹦形目鸟类的特殊色素,可以使羽毛呈现红色、黄色、橙色和绿色等颜色。
【叁】羽色的遗传基础
丰富的羽色让鸟类成为解析颜色遗传基础与适应性演化的绝佳研究对象之一[10, 11]。近年来,综合多组学数据和分析手段,许多研究团队已经在解析鸟类多样化羽色产生的遗传基础方面取得了一系列重要科学发现。例如,Cooke等(2017)分析了鹦鹉绿色和蓝色羽色类型的差异,发现羽色转换是由MuPKS基因第644位发生的精氨酸(R)到色氨酸(W)的替换而引起的,氨基酸替换导致了MuPKS活性丧失,无法沉积黄色色素[12]。
类胡萝卜素作为一种只能从食物中获取的色素,在经过吸收、运输、代谢和沉淀等步骤后才能在羽毛形成着色,这个过程涉及许多重要基因的协同合作[13]。清道夫受体(Scavenger receptors)被认为在介导类胡萝卜素摄取和着色中起着重要作用。Toomey等(2017)通过比较金丝雀白色突变个体与野生黄色个体发现,B类1型清道夫受体(SCARB1) 在突变体中存在一个剪接供体位点上的突变,该突变会引发剪切异常导致受体功能丧失,使得类胡萝卜素无法在白色个体中着色[14]。
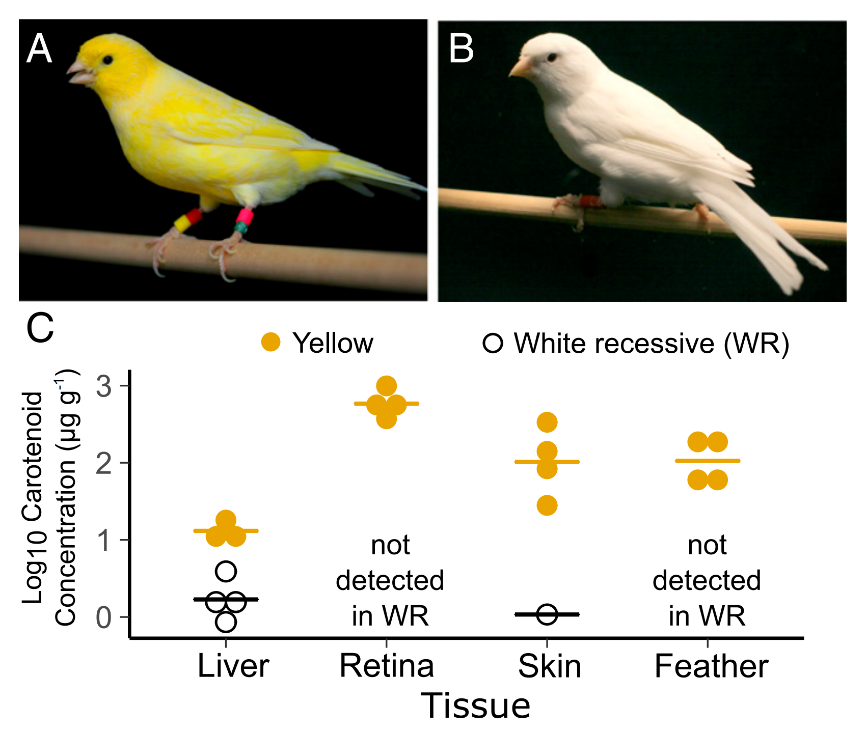
图四. 与野生黄色个体相比,白色突变金丝雀组织中类胡萝卜素含量极低[14]。
许多雀形目鸟类都具有红色羽毛,这与酮化酶将黄色的类胡萝卜素氧化成为红色的酮基类胡萝卜素有关。Lopes等(2016)和Mundy等(2016)的两项研究都揭示了同一种编码细胞色素P450酶的基因,CYP2J19, 是鸟类酮基类胡萝卜素形成的关键酮化酶基因[6, 15]。前者是通过比较分析杂交形成的红色金丝雀(Spinus cucullatus × Se. canaria)与亲本在基因组上的差异,定位了与红色羽毛形成有关的CYP2J19基因,并发现CYP2J19的表达量在红色金丝雀的皮肤和肝脏中显著上调。Mundy等(2016)是以具有黄色喙部的斑胸草雀突变体为研究对象,发现该突变体在鸟喙组织中无法表达CYP2J19。
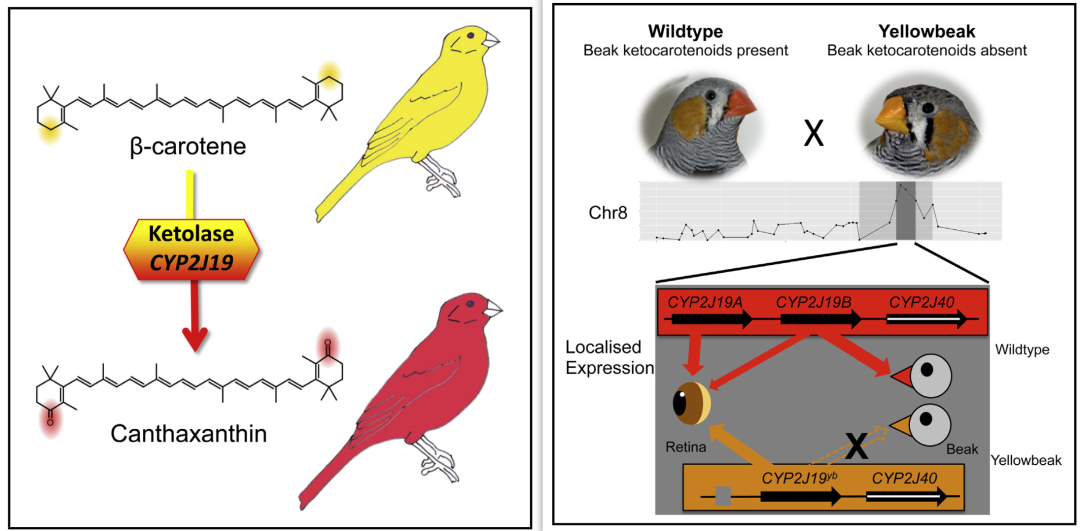
图五. CYP2J19是鸟类酮基类胡萝卜素形成的关键酮化酶基因[6, 15]。
以往研究发现,许多导致羽毛颜色差异的遗传变异是位于非编码区,说明基因表达水平的差异在羽色模式形成中起着重要作用。例如,研究表明,由于顺式调控元件变异,调节类胡萝卜素沉积的重要基因之一BCO2会出现差异表达,这与金丝雀的性别二色性的形成有关[16]。如下图六所示的两种乌鸦,它们在羽毛颜色上存在明显差异。Poelstra等(2014)利用重测序和转录组数据发现,这两个物种中与灰色和黑色羽囊相关的色素基因存在差异表达,表明羽色差异很可能是由基因表达调控的差异引起的[17]。

图六. 全黑的小嘴乌鸦Corvus (corone) corone和有灰色羽毛的冠小嘴乌鸦C. (corone) cornix
【图片来自ebird】
【肆】不止是羽色
鸟类颜色上的差异不仅存在于羽毛,裸露的皮肤、喙、腿、眼圈、虹膜、蛋壳等也同样存在着丰富的色彩。

图七. 喙、腿和鸡冠上的色彩。
【图片来自ebird】
Davis和Clarke(2021)从乌龟、鳄鱼和非雀形目鸟类等4000多种物种中收集了类胡萝卜素在羽毛、眼睛、喙和脸部、颈部、腿部等皮肤上着色的情况,并基于系统发育关系重建了祖先状态[18]。研究人员推断,它们已灭绝的近亲(包括恐龙在内)在皮肤、喙和鳞片上有50%的可能性同样拥有着类胡萝卜素着色,可以形成鲜艳的颜色。但是,爪子和羽毛在祖先就有类胡萝卜素着色的可能性为0%。我们可以想象一下,一群披着黄色、红色和橙色皮肤的恐龙呼啸而过的场景。
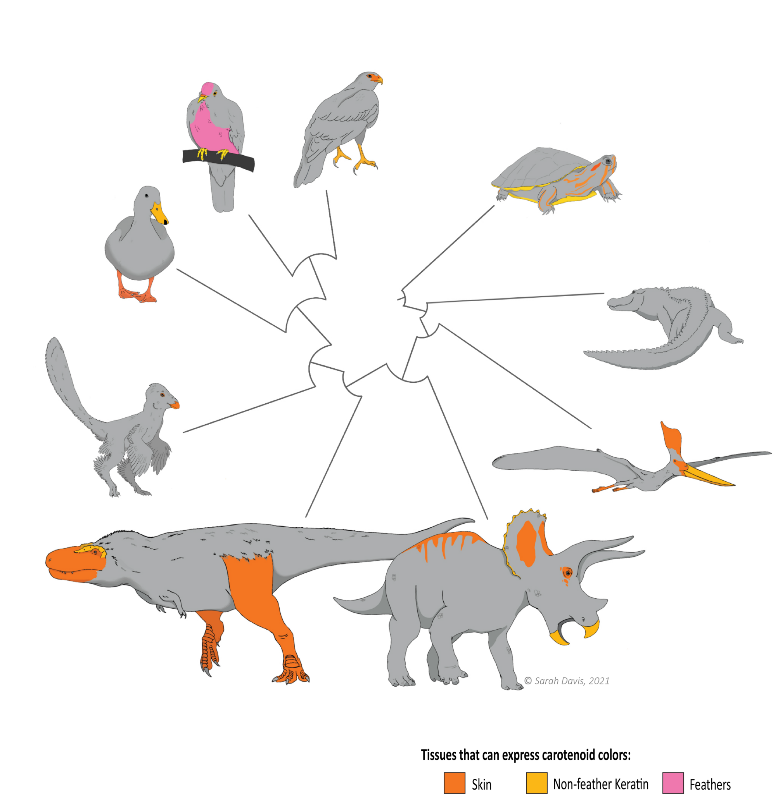
图八. 鸟类和其他现存物种身上出现鲜艳颜色的部位,以及这些颜色可能出现在它们灭绝的近亲(包括恐龙)身上的地方。
【图片来自Sarah Davis,2021】
还有一个部位也同样会存在类胡萝卜素,那就是鸟类的视网膜。与人类相比,鸟类除了多了一类可以响应更短波长的视锥细胞外,它们的视锥细胞内还具有一个特殊的油滴结构。这个油滴含有不同浓度的类胡萝卜素,可以起到滤镜的作用,让视锥细胞的色彩识别更加精确而特异。研究发现,类胡萝卜素在视觉系统和羽色或皮肤中的着色共享许多相同的基因(如前文介绍的CYP2J19,SCARB1和BCO2)。与类胡萝卜素着色相关的基因,CYP2J19,被认为最初是贡献了油滴中的类胡萝卜素代谢形成,之后才在羽毛和身体着色中起作用[1]。那么,视觉感知与羽色形成之间是否存在某种关联?毕竟羽色再华丽要是分辨不出来这么多颜色,也是白费劲。
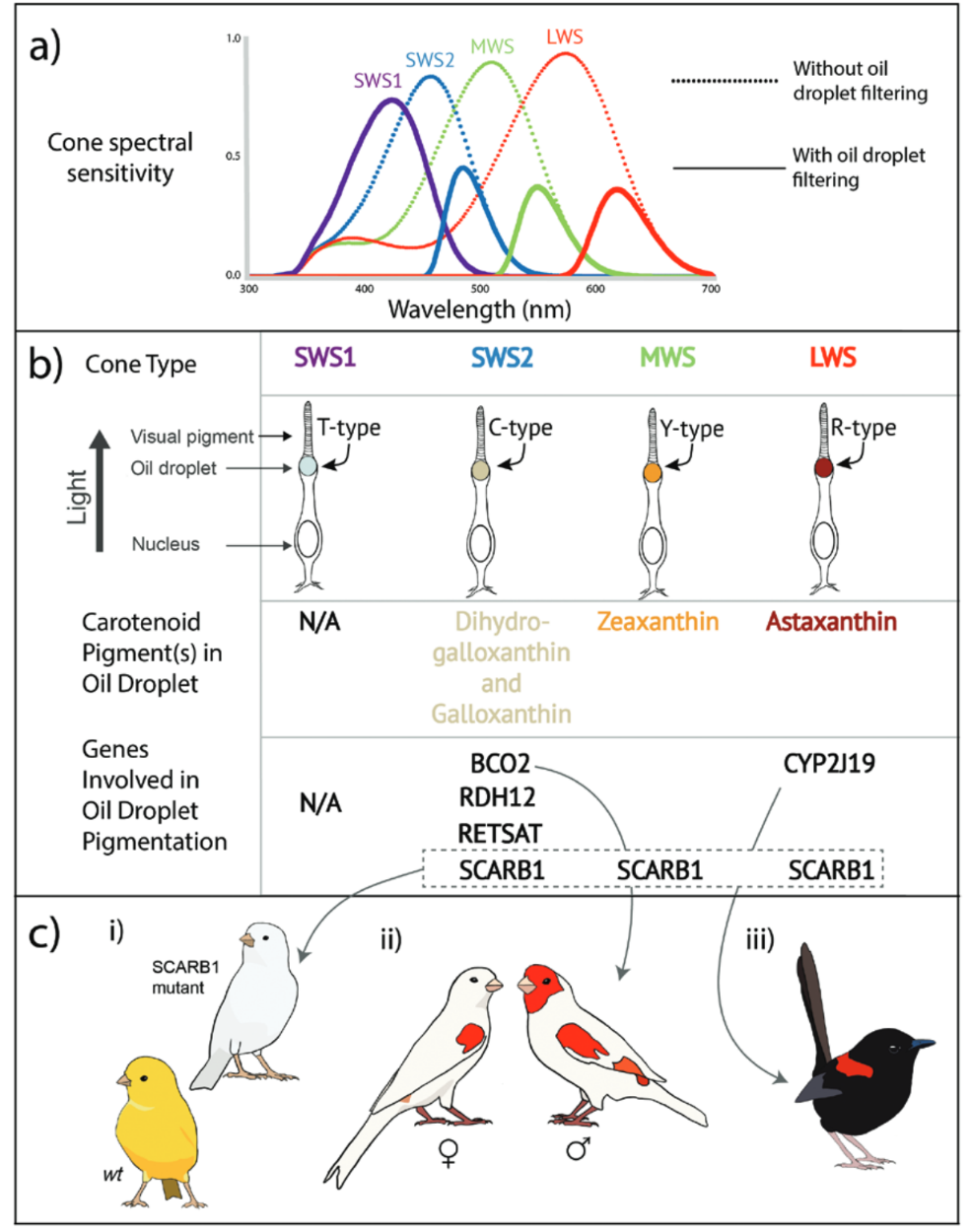
图九. 与类胡萝卜素利用有关的基因在视觉系统和羽毛、皮肤着色中共享[1]。
【伍】不止是颜色
羽色作为鸟类最重要的形态特征之一,受到自然选择和性选择的双重影响。Khalil等(2020)在对红背细尾鹩莺(Malurus melanocephalus)的研究中发现,睾酮可以上调CYP2J19的表达水平,从而增强酮基类胡萝卜素的合成, 使个体具有鲜艳的羽色,更高的性选择优势与繁殖成功率[19]。
事实上,类胡萝卜素在很多研究中被认为是可以衡量鸟类状态的诚实信号(an honest signal)。支持这一观点的依据之一来自资源权衡假说(resource trade-off hypothesis)[20, 21]。由于类胡萝卜素只能从饮食中获取的限制,对其的利用会占用个体在维持免疫系统功能或氧化应激反应方面的资源,因而个体需要进行权衡。那么,能够平衡资源分配的个体,在具有鲜艳羽色的同时也能保证个体生存,就会被认为具有个体优势。但,关于类胡萝卜素能否作为诚实信号仍然存在争论[22, 23]。
鸟类羽色在形成保护色、种间及种内的交流、辅助视觉、热量调节等方面都起着重要作用。例如,Delhey等(2021)基于《世界鸟类手册》中一万多种鸟类的图片,对其羽色和迁徙行为的关联性进行了研究[24]。他们发现,在控制了气候、栖息地类型、体型和性别等因素的影响后,他们发现留鸟的羽色比短距离迁徙候鸟的羽色更深,且显著地比长距离迁徙候鸟更深,这可能与迁徙过程中的温度调节有关。
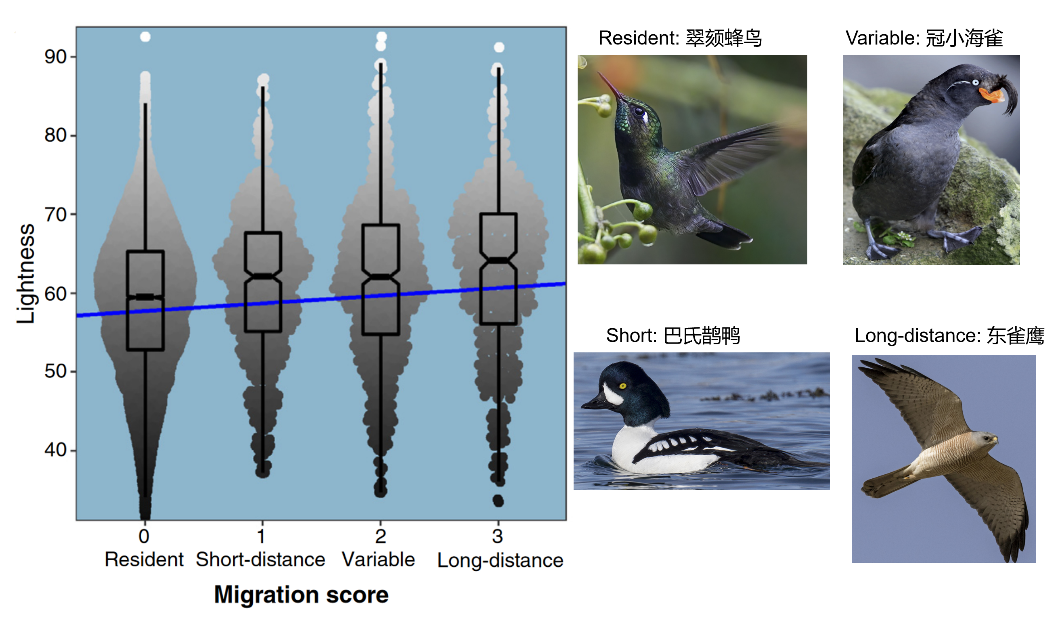
图十. 羽色亮度,随着迁徙距离的增加而增加。
【图片来自ebird】[24]
长期以来,鸟类丰富多彩的表型为生物学家提供了丰富的研究素材。尽管关于羽色的遗传机制研究已经揭示了许多重要基因,但还有很多未解之谜。例如,前边提到的视觉系统和羽色多样化之间的关系,羽毛和皮肤结构色的遗传基础等。相信随着组学技术和分析手段的发展,这些问题都将得到系统深入的解析。

参考文献
1. Price-Waldman, R. and M.C. Stoddard, Avian Coloration Genetics: Recent Advances and Emerging Questions. J Hered, 2021. 112(5): p. 395-416.
2. Inouye, C.Y., Bird Coloration. Volume I: Mechanisms And Measurements. The Condor, 2007. 109(2): p. 482-483.
3. Roy, A., et al., Recent advances in amniote palaeocolour reconstruction and a framework for future research. Biol Rev Camb Philos Soc, 2020. 95(1): p. 22-50.
4. Parnell, A.J., et al., Spatially modulated structural colour in bird feathers. Sci Rep, 2015. 5: p. 18317.
5. Thomas, D.B., et al., Vibrational spectroscopic analyses of unique yellow feather pigments (spheniscins) in penguins. J R Soc Interface, 2013. 10(83): p. 20121065.
6. Lopes, R.J., et al., Genetic Basis for Red Coloration in Birds. Curr Biol, 2016. 26(11): p. 1427-34.
7. McGraw, K., Mechanics of Melanin-Based Coloration, in Bird Coloration. 2006, Cambridge (MA): Harvard University Press. p. 243-294.
8. Galvan, I., et al., Porphyrins produce uniquely ephemeral animal colouration: a possible signal of virginity. Sci Rep, 2016. 6: p. 39210.
9. Ponka, P., Cell biology of heme. Am J Med Sci, 1999. 318(4): p. 241-56.
10. Searcy, W.A., Bird Coloration. Volume 2: Function and Evolution. The Condor, 2007. 109(1): p. 223-224.
11. Orteu, A. and C.D. Jiggins, The genomics of coloration provides insights into adaptive evolution. Nature Reviews Genetics, 2020. 21: p. 461 – 475.
12. Cooke, T.F., et al., Genetic Mapping and Biochemical Basis of Yellow Feather Pigmentation in Budgerigars. Cell, 2017. 171(2): p. 427-439 e21.
13. Toews, D.P.L., N.R. Hofmeister, and S.A. Taylor, The Evolution and Genetics of Carotenoid Processing in Animals. Trends Genet, 2017. 33(3): p. 171-182.
14. Toomey, M., et al., High-density lipoprotein receptor SCARB1 is required for carotenoid coloration in birds. Proceedings of the National Academy of Sciences, 2017. 114: p. 201700751.
15. Mundy, N.I., et al., Red Carotenoid Coloration in the Zebra Finch Is Controlled by a Cytochrome P450 Gene Cluster. Curr Biol, 2016. 26(11): p. 1435-40.
16. Gazda, M.A., et al., A genetic mechanism for sexual dichromatism in birds. Science, 2020. 368(6496): p. 1270-1274.
17. Poelstra, J.W., et al., The genomic landscape underlying phenotypic integrity in the face of gene flow in crows. Science, 2014. 344(6190): p. 1410-4.
18. Davis, S.N. and J.A. Clarke, Estimating the distribution of carotenoid coloration in skin and integumentary structures of birds and extinct dinosaurs. Evolution, 2022. 76(1): p. 42-57.
19. Khalil, S., et al., Testosterone regulates CYP2J19-linked carotenoid signal expression in male red-backed fairywrens (Malurus melanocephalus). Proc Biol Sci, 2020. 287(1935): p. 20201687.
20. Weaver, R.J., et al., Carotenoid metabolism strengthens the link between feather coloration and individual quality. Nat Commun, 2018. 9(1): p. 73.
21. Koch, R.E., et al., Testing the resource trade-off hypothesis for carotenoid-based signal honesty using genetic variants of the domestic canary. J Exp Biol, 2019. 222(Pt 6).
22. Hartley, R.C. and M.W. Kennedy, Are carotenoids a red herring in sexual display? Trends Ecol Evol, 2004. 19(7): p. 353-4.
23. LaFountain, A.M., R.O. Prum, and H.A. Frank, Diversity, physiology, and evolution of avian plumage carotenoids and the role of carotenoid-protein interactions in plumage color appearance. Arch Biochem Biophys, 2015. 572: p. 201-212.
24. Delhey, K., et al., Migratory birds are lighter coloured. Curr Biol, 2021. 31(23): p. R1511-R1512.










