突变率为什么不是零?
1. 什么是突变率
基因突变是DNA在复制过程中发生的错误或者细胞受环境刺激而诱发的DNA序列的改变。基因突变有很多种类,常见的有单碱基替换和小片段的插入/缺失等。我们通常讲的突变率是指单碱基替换的发生频率,常用的单位有每个碱基每次细胞分裂发生的突变数(/base/division)和每个碱基每个世代发生的突变数(/base/generation)。对于单细胞生物来说,这两个单位是相同的。比如出芽酵母的突变率是2×10-10/base/division,也是2×10-10/base/generation。对于多细胞生物来说,这两者差异巨大,比如人类的突变率是1×10-8/base/generation,由于我们不知道人类的一个世代经过多少次的细胞分裂,所以每次细胞分裂的突变率不容易估算,前人推测人类的一个世代中生殖细胞大概经历几十到几百次的细胞分裂。现在有研究估算出一个人类个体的细胞总数是3.7×1013,那我们粗略估算,在不考虑细胞新老更替和组织间差异的情况下,平均每个细胞经历过大概45次的细胞分裂(245≈3.7×1013),按这个数值估算的话人类每次细胞分裂的突变率是2.2×10-10/base/division。
2. 突变率有哪些规律
前人发现了关于突变率的两个重要规律,分别是John Drake报道的微生物突变率的一致性和Michael Lynch报道的有效种群大小与突变率的负相关性。
1998年,John Drake在分析了当时所有已知物种的突变率时发现,在以DNA为遗传物质的微生物中,包括DNA病毒、原核生物和真细胞真菌,虽然它们的基因组差异有近千倍,但是每个世代在每个基因组中发生的突变数量却出奇的一致,均为~0.003/genome/generation (Drake, et al. 1998)。下面的表格是Drake原文中报道的数据,其中G是基因组大小,µb是以/base/generation为单位的突变率,µg是以/genome/generation为单位的突变率。我们可以看到,虽然在不同物种中,G的差异巨大,但是µg却非常一致。
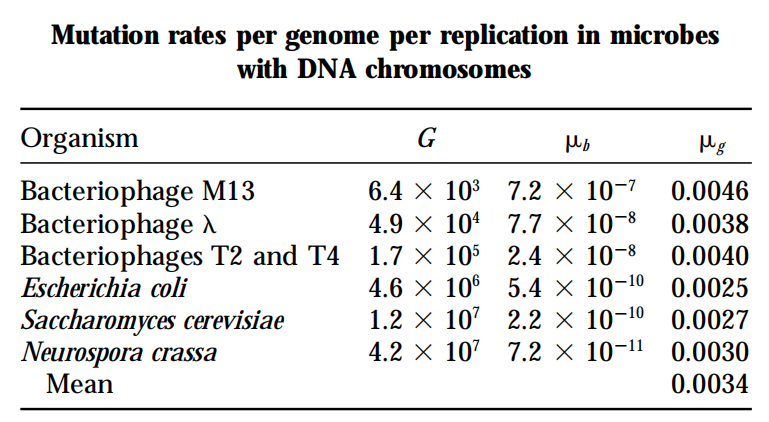
虽然Drake在文章中没有提到这一发现背后的具体原因,但是他认为是被深层次的演化驱动力决定的(原文为“determined by deep evolutionary forces”)。
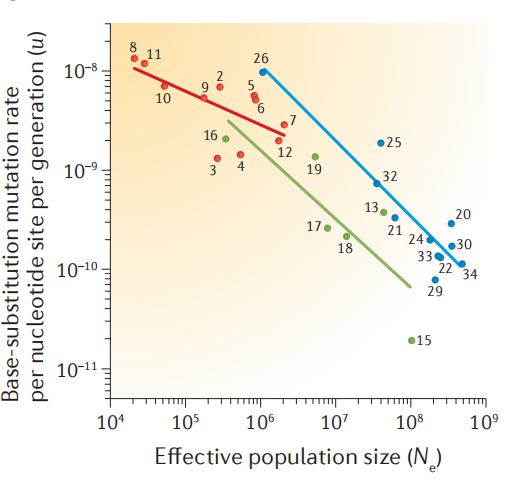
但是,随着近年来多种动物植物的突变率被测定,人们发现许多物种的突变率并不符合Drake发现的规律。取而代之的是Michael Lynch提出的Drift-barrier hypothesis(漂变屏障假说)(Lynch, et al. 2016)。在群体遗传学中有一个非常重要的参数是有效种群大小(Ne),描述的是自然种群中有效的参与后代繁衍的个体数量。自然选择的力量不是无限的,不是所有的有益变异都会被选择保留下来,如果某个变异产生的益处非常小的话,是不会被选择所保留的。而自然选择的力量决定于Ne,Ne越大的种群,自然选择的力量也就越大。Lynch发现的规律是Ne与突变率呈显著的负相关。如下图,在原核生物(蓝色)、单细胞真核生物(绿色)和多细胞真核生物(红色)中分别发现了这个相关性。对此的解释是,作用在突变率上的自然选择是单一方向的压低突变率,即突变率越低对生物越有利。但是自然选择的力量是有限度的,只能将突变率压到一定的水平。因为自然选择的力量与Ne正相关,所以在大Ne的物种中,自然选择的力量越大,突变率就被压的越低。Lynch将自然选择的极限叫做漂变屏障,所以这个假说叫漂变屏障假说。
3. 突变率不是零的可能原因
早在1937年,遗传学家Alfred Henry Sturtevant(遗传学奠基人摩尔根的学生)就发现大多数的突变是有害的,从而提出了著名的问题“为什么突变率不是零”(Sturtevant 1937)。因为基因突变是所有遗传变异的来源,也是物种演化的根本驱动力,所以突变率是如何演化的也吸引了无数遗传学家的注意。关于突变率为什么不是零有以下四个可能的原因。
3.1 物理限制
在1967年,中性理论的创始人木村资生发表的文章中,提出了限制突变率进一步降低的可能原因(Kimura 1967)。第一个可能的原因是物理限制。细胞内的DNA复制酶和突变的修复酶都要遵循物理规律,而完美的DNA复制,即突变率为零,在物理上可能是无法达到的。木村资生在文章中指出,如果我们现在观测的突变率已经达到物理极限的话,那所有可以引起突变率变化的突变都应该是提高突变率,而不会进一步降低突变率。
这一假说可以用我们发表过的一篇文章中的数据检验。我们在引入了很多随机突变的酵母中发现,有些酵母的突变率显著降低,并且找到了在敲除后引起突变率降低的基因(Liu and Zhang 2021)。这些证据表明,至少在出芽酵母中,突变率并没有达到物理极限。
3.2 能量时间消耗
在同一篇文章中,木村资生也提出了妨碍突变率降低的第二个因素,即能量时间消耗。DNA复制后的校对和错误修复是需要消耗能量和时间的。从理论上讲,越高的DNA复制精度,需要消耗越多的能量和时间在校对和修复上。所以在突变率降低到一定程度后,进一步降低突变率所带来的益处会与此消耗的害处相抵消,这个消耗就会阻碍突变率进一步降低。
目前在原核和真核生物中并没有关于此消耗的实验证据。因为检测这个假说需要将某物种的突变率降低,然后观测这个过程是否伴随着适应性或生长速率的降低。但是使突变率降低的方法目前并不清楚。而在RNA病毒中发现基因组的复制速率与精度有负相关性,即基因组复制越快的时候出现的错误也越多(Fitzsimmons, et al. 2018)。如果将病毒基因组的复制速度看作是适应性的高低,则这一发现支持木村资生提出的能量时间消耗假说。
3.3 有益突变
突变并不都是有害的,根据环境和基因的不同,大约有1%的突变是有益的。而这1%的有益突变对物种演化至关重要。如果突变率完全为零的话,物种将无法继续演化,这时如果环境发生变化的话,则物种可能会快速灭绝。
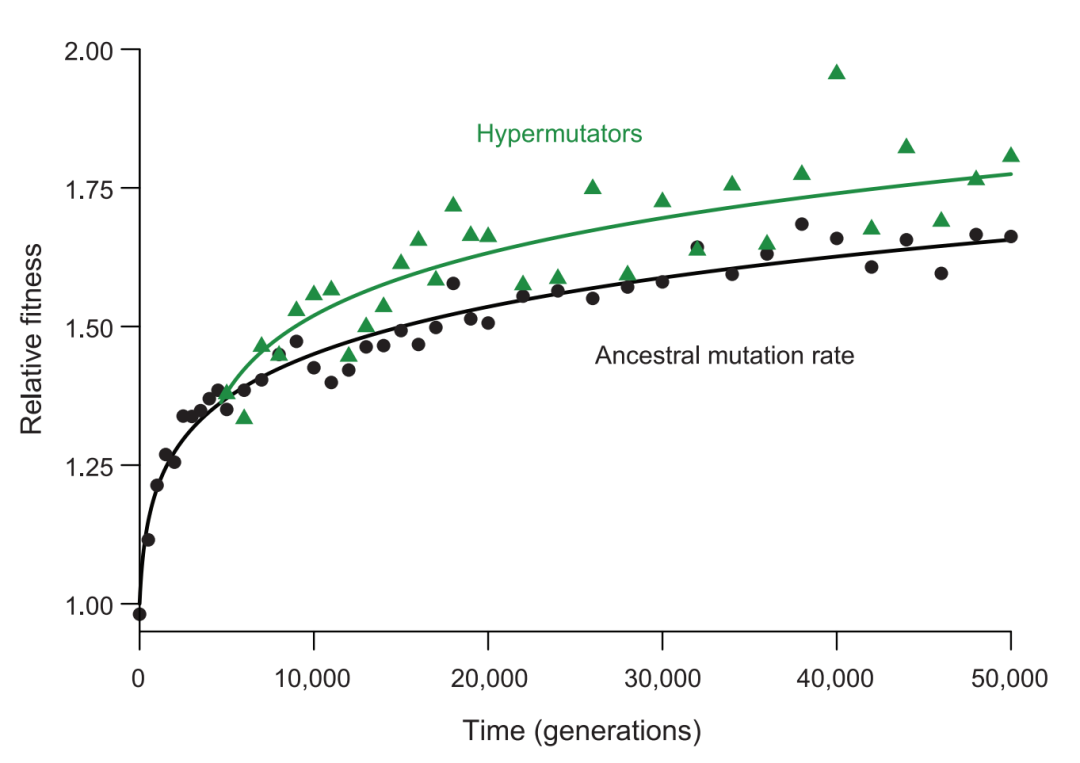
在实验室演化领域,最著名的实验当属Richard Lenski的大肠杆菌实验(https://lenski.mmg.msu.edu/index.html)。这个实验始于1988年并延续至今,实验过程是在单一环境下每天给大肠杆菌传代,使其在该环境下进化。至今大肠杆菌已经进化了超过60,000代。在这个实验过程中,研究者发现有些大肠杆菌的菌株进化出了高突变率的表型,并且这些菌株的进化速率更快(Wiser, et al. 2013)。如下图所示,绿色为高突变率菌株的进化曲线,黑色为正常突变率的进化曲线,可以明显地看出,在经过相同的时间或相同的代数,绿色菌株的适应性明显高于黑色。这个实验说明,由于高突变率会带来更多的有益突变,因此高突变率也会被选择固定下来。
3.4 选择极限
选择极限就是Michael Lynch提出的漂变屏障假说。该假说已经在前文中详细说明过,这里不再赘述。支持该假说的最直接证据是突变率与有效种群大小的负相关性。但是反对该假说的证据也有被报道过,该假说认为突变率受到定向选择的作用(directional selection),而我们过去的研究发现突变率受到稳定选择的作用(stabilizing selection)(Liu and Zhang 2021)。
总结
证实或证伪某个学术假说需要经过逻辑推演或者实验证据的证明。在以上四个阻碍突变率为零的原因中,已经有与物理极限和选择极限的推测不符的实验证据,本文认为能量时间消耗和有益突变更可能是阻碍突变率为零的原因。但是当前支持两者的实验证据较为单一或是间接证据,所以还有待后来研究在此方向上提供更多证据。
参考文献
Drake JW, Charlesworth B, Charlesworth D, Crow JF. 1998. Rates of spontaneous mutation. Genetics 148:1667-1686.
Fitzsimmons WJ, Woods RJ, McCrone JT, Woodman A, Arnold JJ, Yennawar M, Evans R, Cameron CE, Lauring AS. 2018. A speed-fidelity trade-off determines the mutation rate and virulence of an RNA virus. PLoS Biol 16:e2006459.
Kimura M. 1967. On the evolutionary adjustment of spontaneous mutation rates. Genet. Res. 9:23-34.
Liu H, Zhang J. 2021. The rate and molecular spectrum of mutation are selectively maintained in yeast. Nat Commun 12:4044.
Lynch M, Ackerman MS, Gout JF, Long H, Sung W, Thomas WK, Foster PL. 2016. Genetic drift, selection and the evolution of the mutation rate. Nat Rev Genet 17:704-714.
Sturtevant AH. 1937. Essays on evolution I On the effects of selection on mutation rate. Quarterly Review of Biology 12:464-467.
Wiser MJ, Ribeck N, Lenski RE. 2013. Long-term dynamics of adaptation in asexual populations. Science 342:1364-1367.










