性染色体的前世今生
繁殖是生命最基本的特质之一。同样,从亚当夏娃的传说开始,生命的延续就和性别产生了千丝万缕的联系。从最简单的单细胞生物演化至今,生殖的机制也相应地从无性生殖演化到有性生殖。在较为复杂的生物体中,许多物种的性器官产生了两性的分化,并由其生物学特性分为雄性及雌性。但生命如何决定自己的性别,胚胎如何成长为男孩或女孩,这些谜团,在笼罩在中世纪的怪诞理论之下,一切看起来似乎都是无稽之谈。

(Wenzel Peter, Adam and Eve in the Garden of Eden)
当我们回到19世纪末,Gregor Mendel的遗传定律仍蒙尘之时,细胞生物学的研究正随着显微制片等技术的蓬勃发展,进入了日新月异的阶段。在Alexander Fleming, Eduard Adolf Strasburger,Oscar Hertwig等于动植物中发现了有丝分裂和减数分裂后,Wilhelm Waldeyer在1888年正式提出了染色体的概念,为遗传的染色体学说翻开了新的一页。与此同时,August Weismann登高一呼,提出了著名的种质论,翻开了有性生殖的面纱,寓言了生殖细胞的存在。十几年后,地球另一边的Nettie Stevens在黄粉虫(Tenebrio molitor)中第一次观察到了具有显著形态学差异的性染色体。此时此刻,Mendel的工作已然声名鹊起,对遗传因子的讨论也甚嚣尘上,Stevens的发现无疑为Mendelian genetics增添了有力的一笔。



(Gregor Mendel, August Weismann, Nettie Stevens)
继Stevens的之后,人们陆续发现性染色体在种间和种内都具有相当的多样性。因此,学者们推断,性染色体的独立演化在生物的演化史中进行了无数次,并且经常从一个系统转换到另一个系统,这种多样性使得学者能够通过比较分析不同物种间性染色体的演化模式,来总结甚至预测性染色体演化的每个阶段。同时,紧跟分子遗传学在20世纪的燎原之势,埋在多样的性别决定系统之下的本质也逐渐浮出水面,包括被广泛接受的性染色体演化理论,即在性别决定基因及其附近、具有性别特异性的基因之间的区域,其重组会受到选择的影响1, 2, 3。这种性冲突(性拮抗)的理论部分最早源于对孔雀鱼(Poecilia reticulata)着色基因的研究4,在捕食压力较低时,许多着色基因形成了Y染色体的连锁,雄性个体通过鲜艳的体色增加交配机会,从而提高了繁殖率,使雄性收益;相比之下,因为雄性不会被雌性的体色吸引,雌性的收益微乎其微。久而久之,赋予雄性特征的性别决定基因和附近位点上的着色基因形成了连锁,从而产生了一个雄性的超基因,赋予了雄性一定的适应性优势。此后开展的研究,在独立形成的性染色体间确定了趋同的基因组模式5, 6, 7,相应地,人们提出了更多的问题,对于这些物种间特异的区域而言,它的起源是什么,有没有一种保守的力量驱动着它的演化,为什么不同物种的性染色体具有不同的演化速率8?

(Images of guppy from Aquatic Arts)
这些问题的本质,已经远超性染色体研究本身,大量的研究紧随其后。虽然性冲突模型被广泛接受,但介于大部分模式生物的性染色体表现出高度分化的特点,我们很难从前因后果的角度推论支持或反对它的证据,因此,许多代表性染色体发育早期,未产生显著分化的非模式生物数据为解释性染色体如何起源,补充其理论提供了许多佐证9。
回到性染色体本身,自然界中主要有三种性染色体系统,在二倍体阶段产生性别的生物中,哺乳动物拥有XX/XY系统(雄性配子异型),以及鸟类拥有的,相反的ZZ/ZW系统(雌性配子异型)。此外,一些苔藓和藻类在单倍体生命阶段,也同样由性染色体决定性别,它们的性染色体被称为U和V。这些个体在二倍体阶段都是异型的,同时携带U染色体和V染色体;但在单倍体阶段,只存在一个U染色体或V染色体。人们还在一些真菌中发现了更复杂的方式,比如通过多个等位基因来定义遗传上不同的交配类型,而只有两个不同交配类型的单倍体基因组相遇时,重组才会发生10。此外,还有许多其他的性别决定模式,例如在膜翅目中,雄性是单倍体,雌性是二倍体,等等。
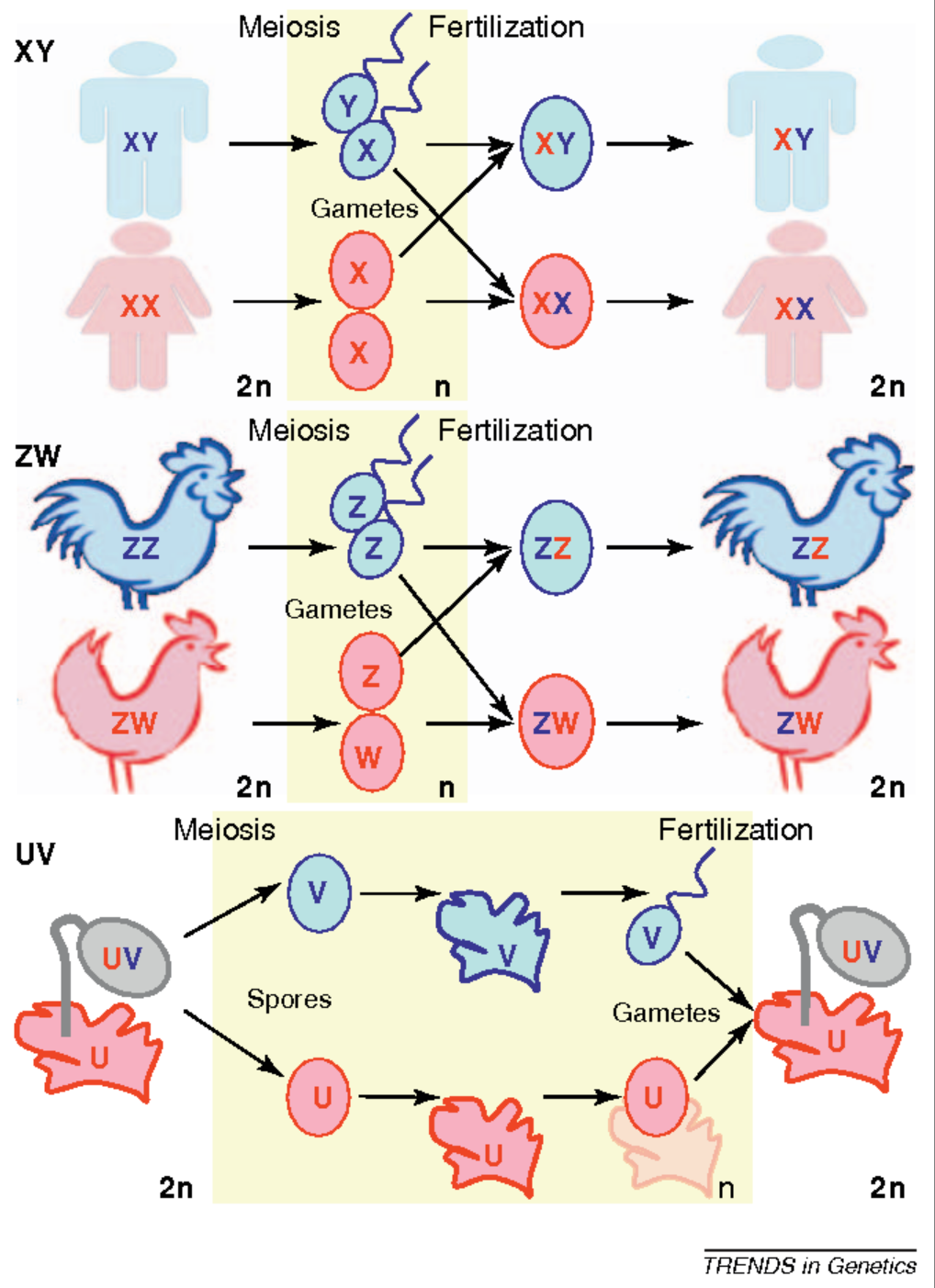
(XY, ZW and UV sex-chromosome systems; Bachtrog, 2011)
那么,性染色体是如何形成的呢?在真核生物中,性染色体的起源多样且独立,在X染色体和Y染色体(以XX/XY系统为例)间表现出不同程度的异型性,正如上文所提,理论上,为了建立性染色体上性别拮抗基因之间的连锁,自然选择增强了X染色体和Y染色体间在减数分裂时的重组抑制,而重组的停止决定了X染色体和Y染色体的分化。性染色体之间的重组抑制几乎能从很小的性别决定区域扩散到几乎覆盖整个Y染色体。而重组抑制通常通过染色体大片段的反转或易位产生,而且是逐步,而不是连续进行的,因此,这种逐步的抑制重组会导致X染色体和Y染色体之间形成具有不同分化程度的阶段性染色体结构,即evolutionary strata11。
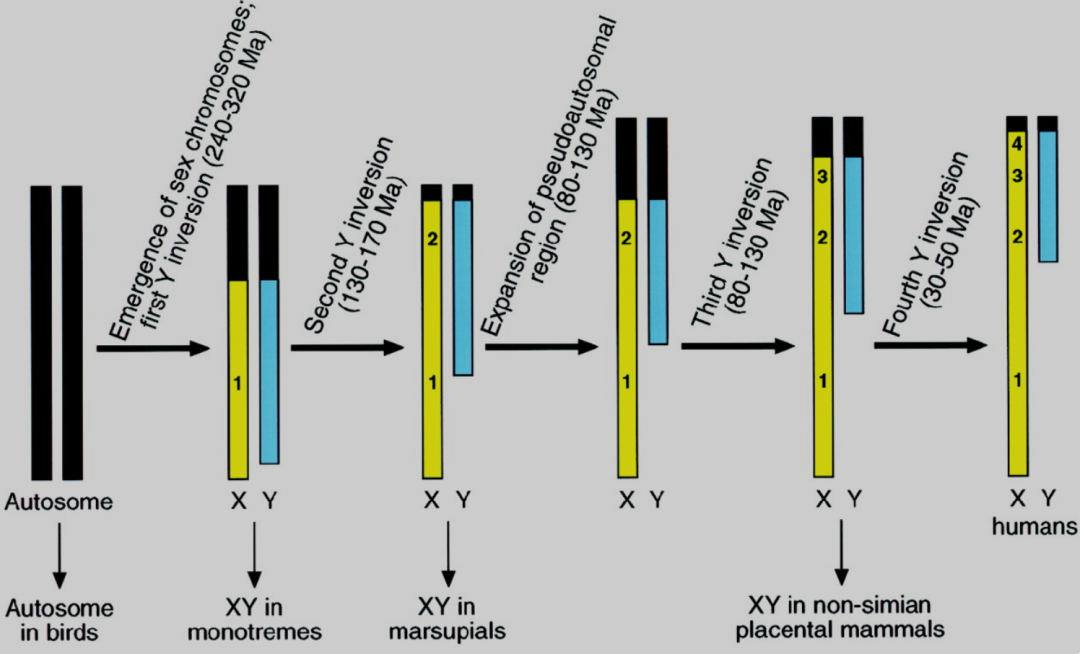
(Four evolutionary strata on the human X chromosome; Page, 1999)
一旦产生了重组抑制,Y染色体上非重组的区域就会收到各种力量的制约,比如自然选择和遗传漂变,从而随着重复序列的累积,急剧退化。此时,如果部分Y染色体基因的退化乃至丢失对雄性产生了有害的影响,X染色体上相应的配子同源基因可以弥补这个缺失,这就是尽人皆知的剂量补偿效应。除了在鸟类等一部分生物外,人们在其余广泛的生物类群中都观察到了剂量补偿效应,其中主要有两种类型:比如果蝇和线虫在雄性中上调X染色体基因的表达,而哺乳动物的X染色体基因的表达在两性中都得到了上调,同时,雌性中有一条X染色体随机失活12。人们还观察到,非重组区域的基因丢失速度也具有显著的区别,其中雄性特异表达的基因丢失的速度较其他基因相去甚远13,这种潜在的适应性表明,强烈的自然选择可能促进了性染色体的男性化和女性化过程,例如选择牵连效应14(Hitchhiking effects)或背景选择15(Background selection)。
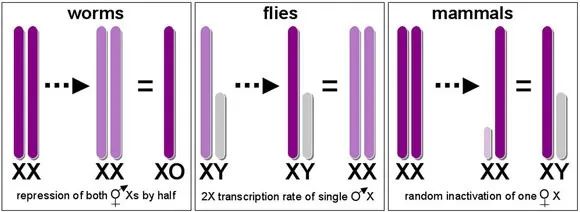
(Diverse strategies for dosage compensation; Meyer, 2005)
此外,由于X染色体和Y染色体之间相同的序列对于雄性减数分裂的配对是必不可少的,许多物种的Y染色体上也存在能够重组的区域,即假常染色体区域(pseudoautosomal region (PAR)),其上分布的基因按照孟德尔定律遗传,比非重组区域的基因具有更高的遗传多样性。当然,部分物种的Y染色体并不具备PAR,它们的染色体在减数分裂中表现为非交叉的模式16(achiasmatic meiosis),这种模式以在雄性果蝇中的发现被人熟知17。
性染色体的退化一般是一个不可逆的过程(Muller ratchet)。但在一些脊椎动物,比如鱼类中,进化出了多样的性别决定因子,使得性染色体在谱系内存在频繁的转化18,也有的物种通过染色体的倒置和融合将常染色体区域与性染色体区域连接,从而产生了新的性染色体19(neo–sex chromosome)。
然而,哺乳动物,尤其是胎盘哺乳动物的性染色体系统高度保守。当Y染色体在1.8亿年前出现在哺乳动物之中,再横跨胎盘哺乳动物150Mya的演化史,我们并没有找到性染色体更替的证据,似乎Y染色体在几百万年后的消失已经成为了必然。我们已经观察到部分啮齿类动物似乎失去了Y染色体,相应的位于Y染色体上的性别决定基因SRY也不复存在。比如最近在奄美刺鼠(Tokudaia osimensis)中的研究发现,在缺少Y染色体的前提下,刺鼠通过雄性常染色体中特异的序列,调控下游致雄基因Sox9的表达,取代了原先SRY的功能,从而成功将原本性染色体的功能转移到了另一条常染色体上20。这是目前人们发现哺乳动物性别决定机制易位的第一个例子,这种新的性别调控机制仿佛影射了我们的未来,诉说着生命终究会找到自己的出路。
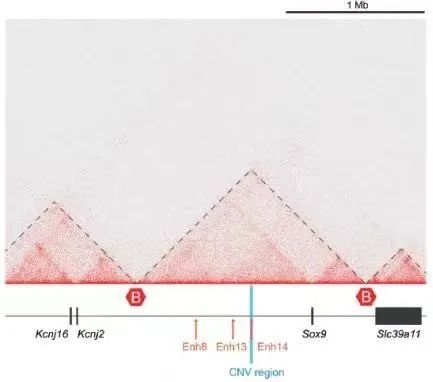
(TAD of SOX9 gene, CNV region refers to the male-specific sequences; Terao, 2022)
参考文献
1. Fisher, R. A. (1931). 093: The Evolution of Dominance.
2. Rice, W. R. (1996). Evolution of the Y sex chromosome in animals. Bioscience, 46(5), 331-343.
3. Bull, J. J. (1983). Evolution of sex determining mechanisms. The Benjamin/Cummings Publishing Company, Inc..
4. Winge, Ö. (1927). The location of eighteen genes in Lebistes reticulatus. Journal of Genetics, 18(1), 1-43.
5. Bachtrog, D., Kirkpatrick, M., Mank, J. E., McDaniel, S. F., Pires, J. C., Rice, W., & Valenzuela, N. (2011). Are all sex chromosomes created equal? TRENDS in Genetics, 27(9), 350-357.
6. Bachtrog, D. (2013). Y-chromosome evolution: emerging insights into processes of Y-chromosome degeneration. Nature Reviews Genetics, 14(2), 113-124.
7. Bachtrog, D., Mank, J. E., Peichel, C. L., Kirkpatrick, M., Otto, S. P., Ashman, T. L., ... & Tree of Sex Consortium. (2014). Sex determination: why so many ways of doing it? PLoS biology, 12(7), e1001899.
8. Wright, A. E., Dean, R., Zimmer, F., & Mank, J. E. (2016). How to make a sex chromosome. Nature communications, 7(1), 1-8.
9. Zhou, Q., Zhang, J., Bachtrog, D., An, N., Huang, Q., Jarvis, E. D., ... & Zhang, G. (2014). Complex evolutionary trajectories of sex chromosomes across bird taxa. Science, 346(6215), 1246338.
10. Nieuwenhuis, B. P., & James, T. Y. (2016). The frequency of sex in fungi. Philosophical Transactions of the Royal Society B: Biological Sciences, 371(1706), 20150540.
11. Lahn, B. T., & Page, D. C. (1999). Four evolutionary strata on the human X chromosome. Science, 286(5441), 964-967.
12. Meyer, B. J. (2005). X-Chromosome dosage compensation. WormBook: The Online Review of C. elegans Biology [Internet].
13. Nozawa, M., Onizuka, K., Fujimi, M., Ikeo, K., & Gojobori, T. (2016). Accelerated pseudogenization on the neo-X chromosome in Drosophila miranda. Nature communications, 7(1), 1-9.
14. Smith, J. M., & Haigh, J. (1974). The hitch-hiking effect of a favourable gene. Genetics Research, 23(1), 23-35.
15. Charlesworth, B., Morgan, M. T., & Charlesworth, D. (1993). The effect of deleterious mutations on neutral molecular variation. Genetics, 134(4), 1289-1303.
16. De la Fuente, R., Parra, M. T., Viera, A., Calvente, A., Gómez, R., Suja, J. Á., ... & Page, J. (2007). Meiotic pairing and segregation of achiasmate sex chromosomes in eutherian mammals: the role of SYCP3 protein. PLoS genetics, 3(11), e198.
17. McKee, B. D., Yan, R., & Tsai, J. H. (2012). Meiosis in male Drosophila. Spermatogenesis, 2(3), 167-184.
18. Takehana, Y., Matsuda, M., Myosho, T., Suster, M. L., Kawakami, K., Shin-i, T., ... & Naruse, K. (2014). Co-option of Sox3 as the male-determining factor on the Y chromosome in the fish Oryzias dancena. Nature communications, 5(1), 1-10.
19. Sigeman, H., Strandh, M., Proux-Wéra, E., Kutschera, V. E., Ponnikas, S., Zhang, H., ... & Hansson, B. (2021). Avian neo-sex chromosomes reveal dynamics of recombination suppression and W degeneration. Molecular biology and evolution, 38(12), 5275-5291.
20. Terao, M., Ogawa, Y., Takada, S., Kajitani, R., Okuno, M., Mochimaru, Y., ... & Kuroiwa, A. (2022). Turnover of mammal sex chromosomes in the Sry-deficient Amami spiny rat is due to male-specific upregulation of Sox9. Proceedings of the National Academy of Sciences, 119(49), e2211574119.










