新物种诞生的必经之路:生殖隔离
当我们对演化生物学中大多数科学问题进行讨论时,都要从1859年达尔文的《物种起源》问世说起。达尔文认为,差异环境下自然选择导致了物种的演化和形成。物种间在交配或受精前后存在障碍往往标志着新物种的形成。换句话说,当来自产生分化的群体的个体不再将原来群体个体视为潜在的交配者,或者交配的机会受到栖息地或繁殖时间差异的限制时,新物种就产生了。
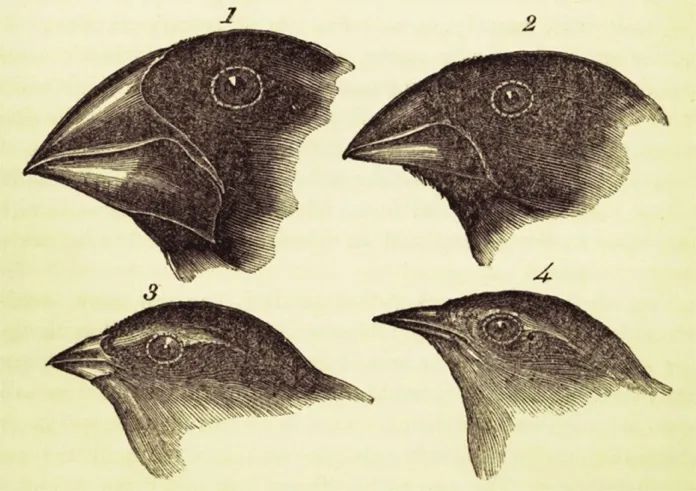
图一 达尔文在其1839年出版的《贝格尔号游记》中勾勒的雀类图
在达尔文时代,一些生物学家就认为物种应该根据它们能否产生可育后代来区别,而生殖隔离(Reproductive isolation; RI)这个术语首次出现是在上世纪三十年代(Emerson, 1935, Ann. Entomol. Soc. Am),直到20世纪中后期才引起了广泛关注,并对其进行了多个方向和角度的定义,主要体现在有机体和遗传水平。
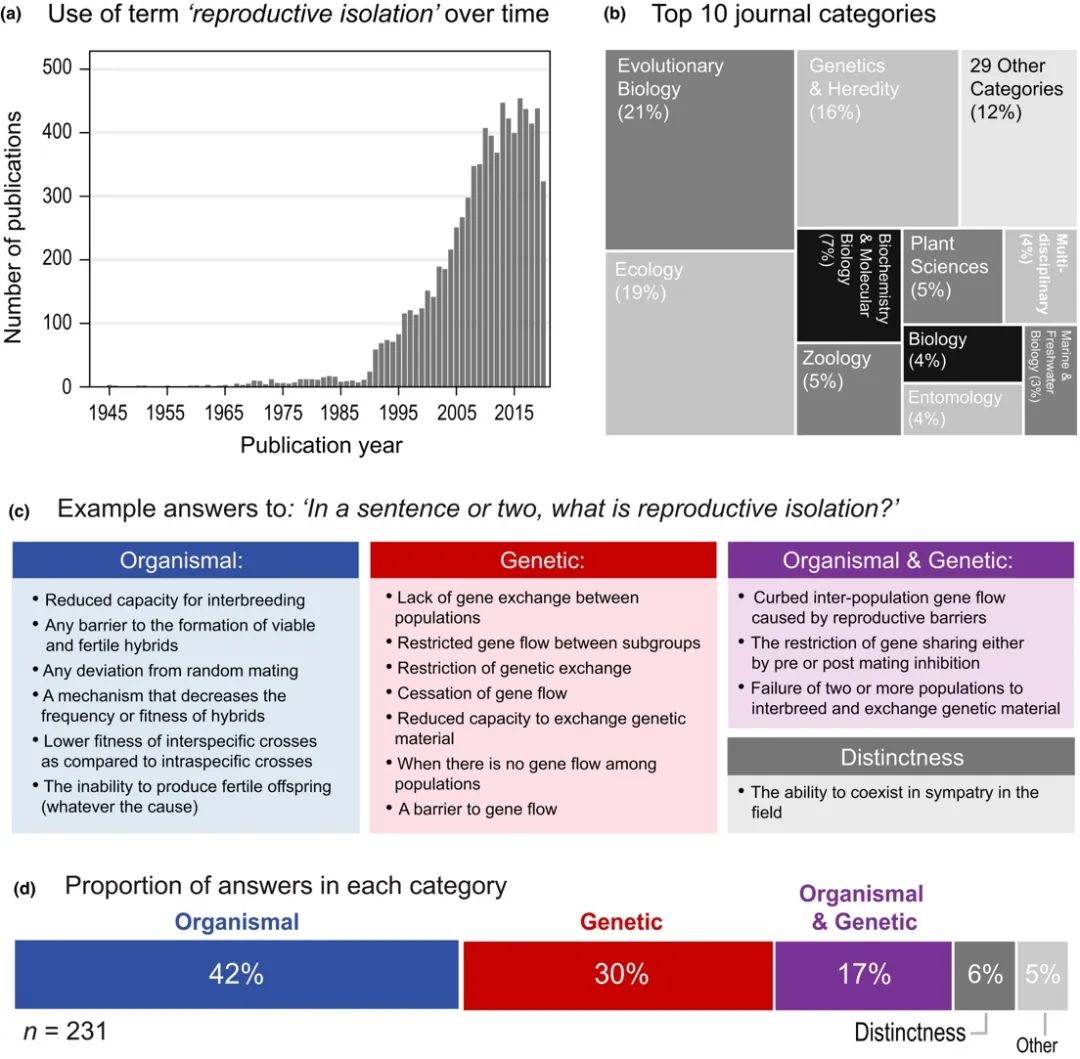
图二 生殖隔离在文献中的引用及多种定义(Westram et al., 2022, J. Evol. Biol.)
生殖隔离在早期物种形成时往往表现比较微弱,但在后期就会非常明显。在某种情况下,不同群体之间尽管存在生殖隔离,也会出现交配的情况,然后产生可能存活,或死胎,或不可育的杂交后代,这种不同程度的合子前后生殖障碍决定了种群是如何彼此隔离的,以及在连续的物种形成过程中进化了多久。
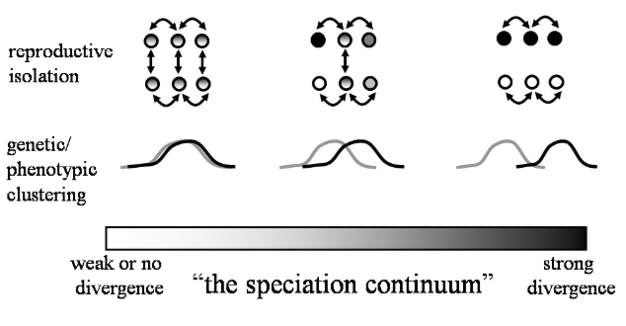
图三 物种形成的持续分化示意图(Nosil et al., 2009, Trends Ecol. Evol.)
生殖隔离的分类及量化
生殖隔离又称为生殖屏障,生物学上指由于生殖方面的原因,即使地理关系相近,但物种不同的类群之间不能互相交配,或不易交配的隔离机制,该机制集进化机制、行为和生理过程于一体,对于物种形成至关重要,这些屏障会通过减少相关物种之间的基因流动来维持物种的完整性(https://en.wikipedia.org/wiki/Reproductive_isolation)。生物学家恩斯特·瓦尔特·迈尔将生殖隔离划分为两类:受精(交配)前和受精后。
合子形成前的生殖隔离包括时空、栖息地、交配行为和配子的不相容。如在鱼类Gasterosteidae刺鱼科中的两个物种中,一个终年生活在淡水中,另一个在冬天生活在海里,但在春天和夏天它们会迁移到河口繁殖,由于两个种群对不同盐浓度环境的适应会产生生殖隔离;有些植物物种如紫露草属中的T. canaliculata与T. subaspera,尽管同域分布,但由于花期不同也会产生生殖隔离;另外,即使物种间表型仅存在微小的差异,不同的交配行为也会产生生殖隔离,如D. melanogaster黑腹果蝇与D. simulans拟果蝇由于形态极其相似,被认为是双胞胎物种,但是在实验中即使被放置在一起也不会交配,研究表明当雄性向两个物种的雌性求爱,雌性表现出明显的物种偏好性,并发现在这两个物种的第2号染色体上存在一个不同的调节区域影响着雌性的选择行为;在珊瑚礁中,许多种珊瑚的同步产卵意味着当数十种的数百个个体的配子同时被释放到同一水域时,可以发生种间杂交,但是有三分之二的杂交存在不相容,但是这种配子不相容机制尚不清楚;在植物中,一个种的花粉粒可以在柱头中发芽,并以其他种的方式生长,然而花粉管的生长可能在柱头和胚珠之间的某个点被抑制,这样受精就不会发生,这种生殖隔离机制在被子植物中很常见,称为杂交不亲和性。
合子形成后的生殖隔离包括合子死亡、杂交后代无法生存以及杂交后代不育。在植物和动物中都经常出现这样一种不相容性。如在蛙属的不同种之间的杂交程度差异很大,有些杂交后的合子甚至没有第一次有丝分裂,有些物种间的杂交囊胚期可以正常有丝分裂,但是原肠胚期停止分裂,还有一些在最初的阶段是正常的,但在胚胎发育的最后阶段发生错误,这表明在这些物种中不同胚胎发育阶段基因的分化差异导致了杂交种的无生存力。在动物中属间杂交往往无法成功,山羊属与绵羊属间的杂交后代大多为死胎,即使是存活的后代也大多报道于母山羊与公绵羊的杂交;牛属和水牛属之间的杂交在体内受精没有成功的先例,但是体外受精可以实现,受精卵也只能发育到囊胚阶段;珠鸡属和原鸡之间可杂交,但是正反交会影响后代存活率,且雄性不可育。在被子植物中,胚胎的成功发育依赖于胚乳的正常功能,在许多不同倍体间杂交和具有相同倍性水平的物种的某些杂交中,已经观察到胚乳发育失败,而胚乳坍缩和随后的杂交胚胎流产是被子植物中最常见的受精后生殖隔离机制之一。

图四 植物中形成合子前后的生殖障碍类别(Baack et al., 2015, New Phytol.)
然而,同一属内有些跨物种杂交后代不仅能够存活,杂交后代也表现出不同程度的可育性,如在鱼类中,Ctenopharyngodon idella草鱼与大头鱼Aristichthys nobilis杂交后代为三倍体,但是普遍不育,而Hypophthalmichthys molitrix鲢鱼与大头鱼Aristichthys nobilis杂交后代优势明显并可育;猪属内家猪与野猪可杂交且产生可育后代;绵羊属内物种间染色体数目不同,但物种间杂交后代可育;原鸡属内家鸡和4个野生种原鸡之间均可杂交且产生可育的后代;水牛属内河流型水牛和沼泽型水牛亚种间可以杂交且后代可育;牛属内家牛和野牛可以杂交,但F1代雄性生育力低下,雌性可育;马属内马与驴的杂交F1代(骡子)基本不育,雌性中可以发现一些成熟的卵子,但雄性个体没有发现有活力的精子;鼠属中的家鼠包含三个亚种,这些亚种之间杂交后代雄性表现出生育力低下或者不育。
对于这种不同程度的生殖隔离,科学家们尝试了很多方法试图去量化它(包括前面提到的有机体水平和遗传学水平),Westram等人(2022, J. Evol. Biol.)用种群间遗传差异对基因流动的影响来对生殖隔离进行定量度量,具体来说,将存在遗传差异与没有遗传差异的的中性等位基因流动进行比较,当种群间的遗传差异减少了中性等位基因的流动时,RI大于零,当然作者也进一步提到,RI的测量还依赖于环境,包括空间、时间和基因组的影响。
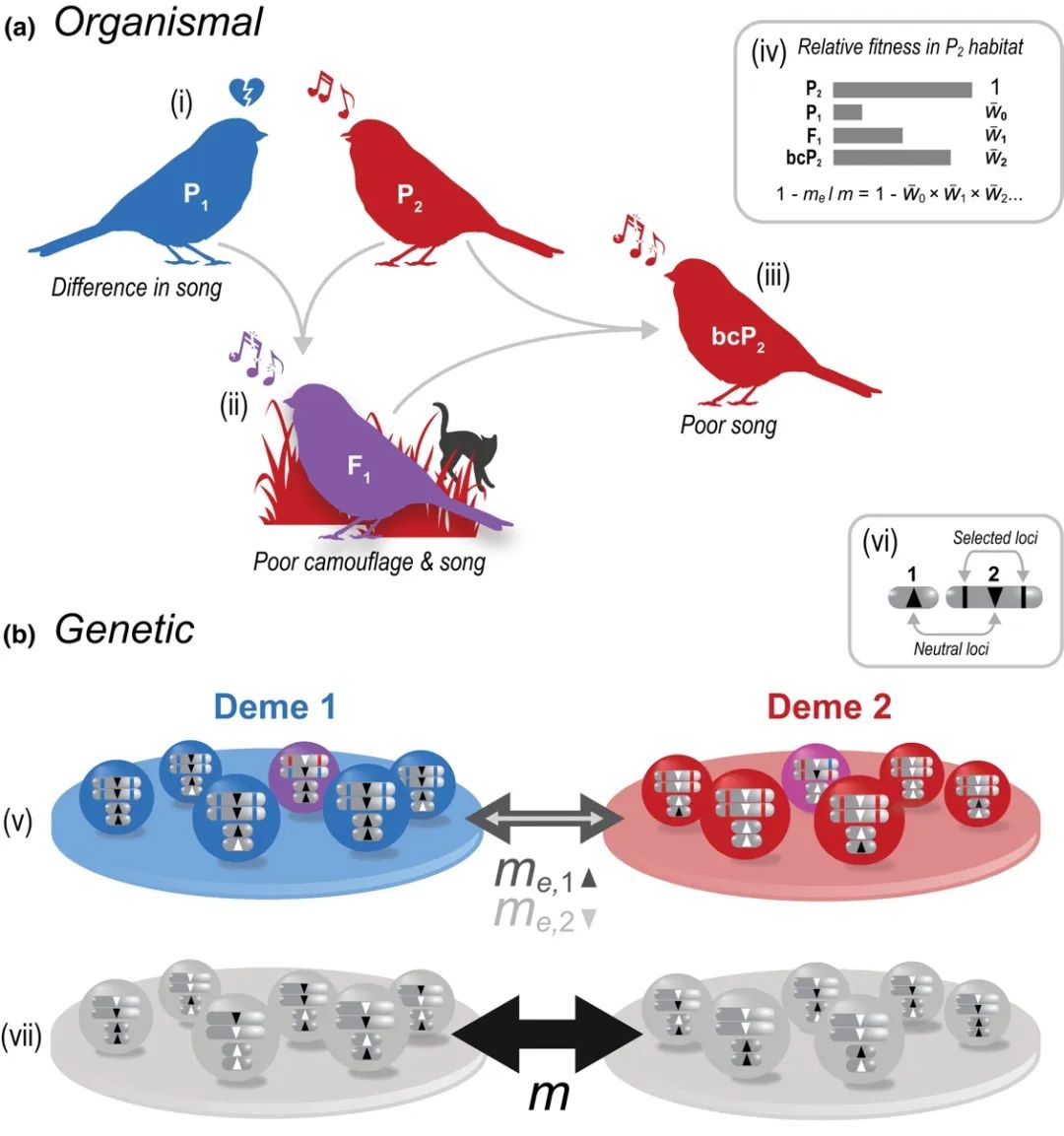
图五 有机体水平和遗传水平量化生殖隔离(Westram et al., 2022, J. Evol. Biol.)
生殖隔离的遗传机制
生殖隔离会导致种群间的分化,并最终导致物种形成,是生物多样性的基石。酵母是研究生殖隔离机制的一个很好的例子,例如在酵母属Saccharomyces内一系列相关的物种中,发现来自作用于父母本的差异序列的DNA错配修复是调控生殖隔离的机制,而不是常常谈及的染色体重排和基因不相容机制(Greig, 2009, Heredity)。Lee等人(2008, Cell)报道了在S. cerevisiae和S. bayanus之间核基因与线粒体基因之间的不相容,这为“物种形成”基因提供了首个例子,他们发现在F1代产生的低于1%的可存活的后代中,S. bayanus中在线粒体中发挥功能的位于13号染色体的AEP2基因不能调控来自S. cerevisiae的线粒体基因组的OLI1基因的mRNA的翻译,当F2代中同时出现S. bayanus的核基因组和S. cerevisiae的线粒体基因组时,就会产生生殖隔离,使其无法进行有丝分裂而存活,作者认为AEP2基因和OLI1基因可以代表“物种形成”基因,而对使用非发酵碳源的适应性促进了这些基因的分化,从而导致物种形成。研究还发现在S. cerevisiae的分离株中,PMS1和MLH1基因存在不相容的情况(Heck et al., 2006, P.N.A.S.),这两个基因通过相互作用形成异质二聚体在DNA错配修复中发挥功能,但是这些基因的等位基因的组合却导致其无法发挥功能,从而使得缺乏DNA错配修复而导致非常高的突变率。
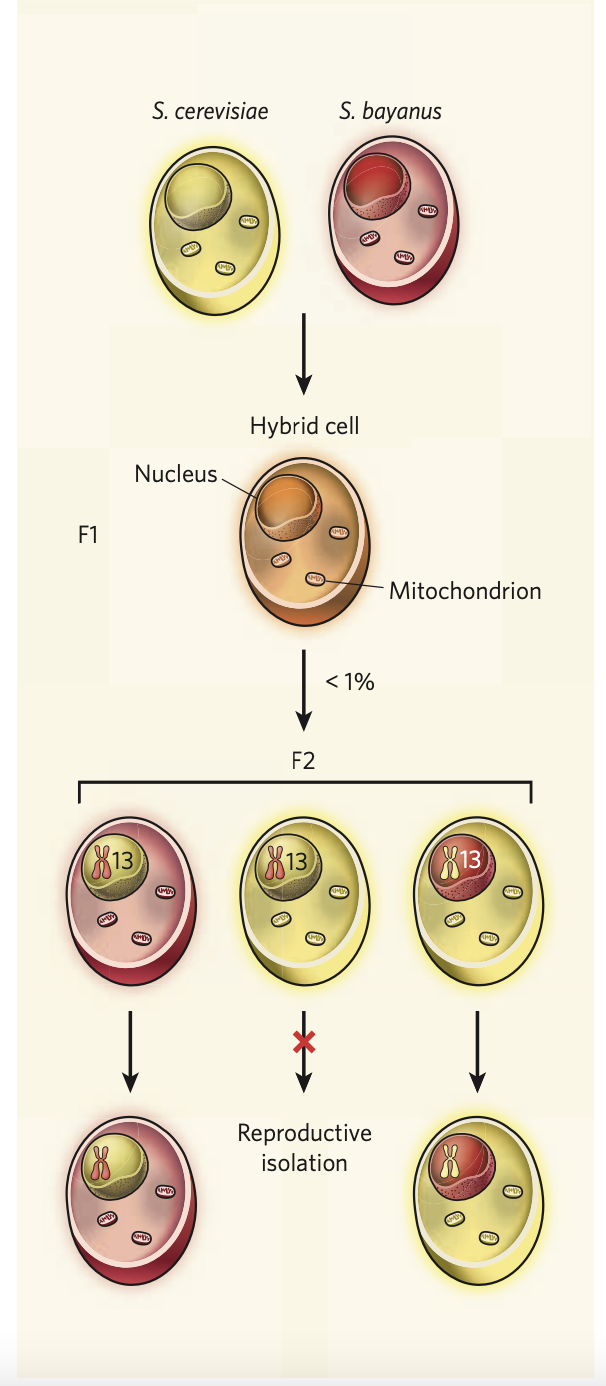
图六 酵母中核基因组和线粒体基因组不相容引起的杂种不育示意图(Lee et al., 2008, Cell)
提到生殖隔离,还不得不提到“哈尔丹法则”(Haldane, 1922, J. Genet.),即跨物种杂交雄性不育,但是不影响雌性。最为典型的就是小鼠的亚种之间的杂交(公鼠Mus musculus domesticus × 雌鼠Mus musculus musculus),研究发现在雄性个体中PRDM9基因是导致其不育的主效基因,在对该基因重编程后,会逆转杂交雄性小鼠的不育性(Davies et al., 2016, Nature)。另外,在牦牛和家牛的杂交中雄性不育也普遍存在,其F1代雄性睾丸不存在发育成熟的精子,研究认为尽管牦牛和家牛染色体数目一致,但是Y染色体结构的差异(家公牛为中间着丝粒染色体,而公牦牛及其杂种为亚中间着丝粒染色体)、X连锁基因过度表达、F1代X与Y染色体之间缺乏假常染色体同源区域等原因会导致其不育(Gupta et al., 1996, J. Genet.; Campbell et al., 2013, Genetics; Dumont, 2017, Genetics)。
植物中基因不相容、不同的基因沉默、染色体重排、多倍体的产生都会导致生殖隔离(Baack et al., 2015, New Phytol.)。如水稻中,Oryza sativa japonica和O. sativa indica的杂交种生殖力低下,其遗传机制复杂,包括三个连锁的位点,其中两个会产生“死亡”表型,而胚珠因为缺乏第三个位点的保护基因型而导致流产。细胞质雄性不育在植物中普遍存在,表现为母体遗传、花粉败育和雌蕊正常,研究表明有些物种杂交雄性不育是由于线粒体中来自一个物种的不育等位基因的出现和来自另一个物种的修复等位基因的缺失导致。另外,染色体重排可以通过改变基因座位置、降低物种间重组和基因流来促进生殖隔离,植物中导致生殖隔离的最普遍的染色体重排类别是倒位和易位,它们能够改变染色体上基因座的位置导致基因不相容,易位还降低了染色体断点或着丝粒附近的重组率。另外,当一个新四倍体由二倍体产生时,它们的杂交F1代为三倍体,三倍体往往由于胚乳发育不良无法存活,即使存活往往由于减数分裂失败,使得产生种子的概率和适应度也大大降低。
杂交个体不育往往是由于F1代在减数分裂后产生的配子无法存活,但是前面也提到,有些物种间的杂交尽管存在生殖隔离,但是也能产生可存活且可育的后代。如在绵羊属的跨物种杂交中,Li等(2022, Genome Res.)利用野生马可波罗盘羊(O. ammon polii; 2n = 56)和家养绵羊(Ovis aries; 2n = 54)构建了跨越5代的大型杂交后代群体,揭示了从山羊(C. hicus)到绵羊属的染色体进化机制,发现由于盘羊与家羊近缘关系近,染色体序列高度同源,其杂交产生的F1代(2n = 55)在减数分裂时当产生平衡或健康的配子时就能够可育。
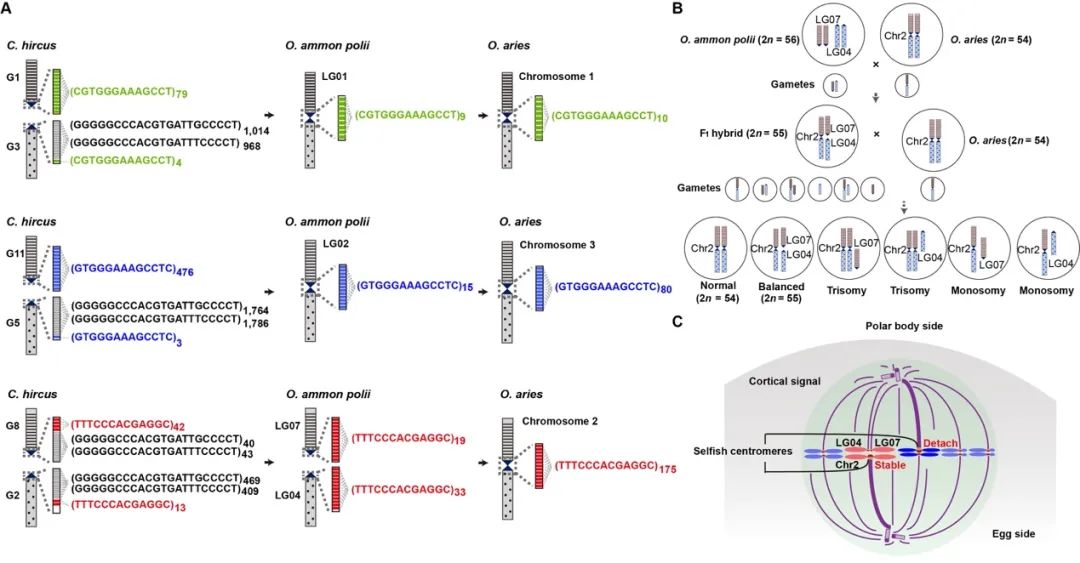
图七 绵羊属染色体进化及杂交F1代可育机制图(Li et al., 2022; Genome Res.)
染色体进化与物种形成距离多远?
纵观哺乳动物的生命之树,染色体数目从M. muntjak vaginalis雌性印度麂的2n = 6跨越到Tympanoctomys barrerae阿根廷胶鼠的2n = 102(Ferguson-Smith et al., 2007, Nat. Rev. Genet; Pardo-Manuel et al., 2001, Genetics),即使近缘关系比较近的物种,染色体数目差异也非常大,如在啮齿目(2n = 10~102)( Romanenko et al., 2012, Heredity)、长臂猿科(2n = 38~52)(Carbone et al., 2014, Nature)、麂属(2n = 6/7~46)( Wang et al., 2000, Mol. Biol. Evol.)中,而导致这种染色体数目差异的主要原因还是染色体间的融合和断裂,而且研究发现这种融合和断裂往往发生在染色体的端粒或着丝粒的高度重复区域(Yin et al., 2021, Nat. Commun.)。
不难发现,同一属内很多近缘物种染色体数目不一致,尽管它们之间杂交依然可以产生可育的后代,但是也明显存在不同程度的生殖隔离,这样让人不禁提问,是否染色体进化在物种形成上也发挥着重要作用呢?研究发现人类新生儿中总会有千分之一的概率出现染色体融合的情况,而且这种罗伯逊易位往往发生在13号、14号、15号、21号和22号近端粒着丝粒染色体中(Therman et al., 1989, Ann. Hum. Genet.),Song等人(2016, Mol. Cytogenet.)报道了一例发生14号和15号染色体融合的正常携带者(2n = 44), 其父母染色体数目均为45条,而且结果发现作为纯合子的儿子(2n = 44)产生平衡/正常的配子概率(99.7%)远高于其杂合子父亲产生平衡/正常的配子概率(79.9%)。这些有趣的现象让我们再次联想:为什么人类总会有千分之一的概率出现染色体融合呢?这对人类演化有什么帮助?是不是当核型为2n = 44的个体出现时,暗示有可能会有新的物种出现?这些问题都值得我们进一步深入思考和探索。










