EES讨论第三期|演化的生态位构建理论——生物与环境互为因果
自Julian Huxley划时代的《演化:现代综合》(1942)问世以来,现代综合演化论(the Modern synthesis)一直在无数的批评、重申与阐述下蓬勃发展[1],并深刻地影响了人们看待生物界的视角。在此基础上,扩展演化综论(Extended evolutionary synthesis, EES)并不寻求提出理论革新,而是引导对容易被主流视角忽略现象的思考和研究。
例如,在涉及生物和环境的关系时,演化生物学家们或许习惯于做“远因”与“近因”的区分,并以“基因与环境制造表型,环境筛选有利表型,种群基因频率改变”的方式叙事。而扩展演化综论者认为,这样的叙事会让人习惯性地以基因为中心思考,并将环境作为一成不变的背景板或竞技场,而忽略了生物是环境的重要组分,而前者又处于动态的变化和交互之中。此外,生物对环境的积极修改,通常会放大有利于自己生存的因素——这使得生物“构建”的环境与自然环境存在系统性差异。
(有关扩展演化综论的更多主张,见【EES讨论第一期】)
本期讨论围绕扩展演化综论对生物和环境关系的看法展开。在开始破题前,首先需要明确我们在谈论什么概念,以避免不必要的,语义上的争执——那就是,什么是生物,什么是环境?
通常,当我们关注某一生物个体,环境便可以被简单定义为“该个体本身以外的一切非生命理化因素和生物因素”。因此,我们事实上只需讨论一个问题,即什么是生物个体,或称“有机体”?
本期讨论围绕扩展演化综论对生物和环境关系的看法展开。在开始破题前,首先需要明确我们在谈论什么概念,以避免不必要的,语义上的争执——那就是,什么是生物,什么是环境?
通常,当我们关注某一生物个体,环境便可以被简单定义为“该个体本身以外的一切非生命理化因素和生物因素”。因此,我们事实上只需讨论一个问题,即什么是生物个体,或称“有机体”?
“有机体”:动态的物质与功能整体
一只猫同一块石头,或一块肥肉的区别是显然的。通过对照,我们可以归纳出“活”的有机体具有的一系列特征,如“结构完整性”“遗传均质性”“新陈代谢”“响应刺激”“生长繁殖”“适应和改变环境”等。其中,前两条强调了“个体性”[2],后几条则定义在该个体上。

“不努力就会变成玩物”:猫咪和肥肉并不总是那么容易界定
(图源:刘虹均)
但是,放眼生命之树的其他部分,我们会发现,界定有机体处于哪一层级其实并不容易[3]。
例如,巨大的远洋水螅类生物管水母[4]通常被认为是成千上万分工明确的“个体”组成的群体;但是这些“个体”由共肉(coenosarc)物理连接,共享消化道,且因克隆生长而具有相同的遗传物质,又可以被视为具有特殊器官发育模式的个体。还有之前讨论过的社会性昆虫【“我即是虫群”?以“超个体”的视角看待蚁群】,它们同管水母一样,都被某些学者称作“超有机体”[5][6]。
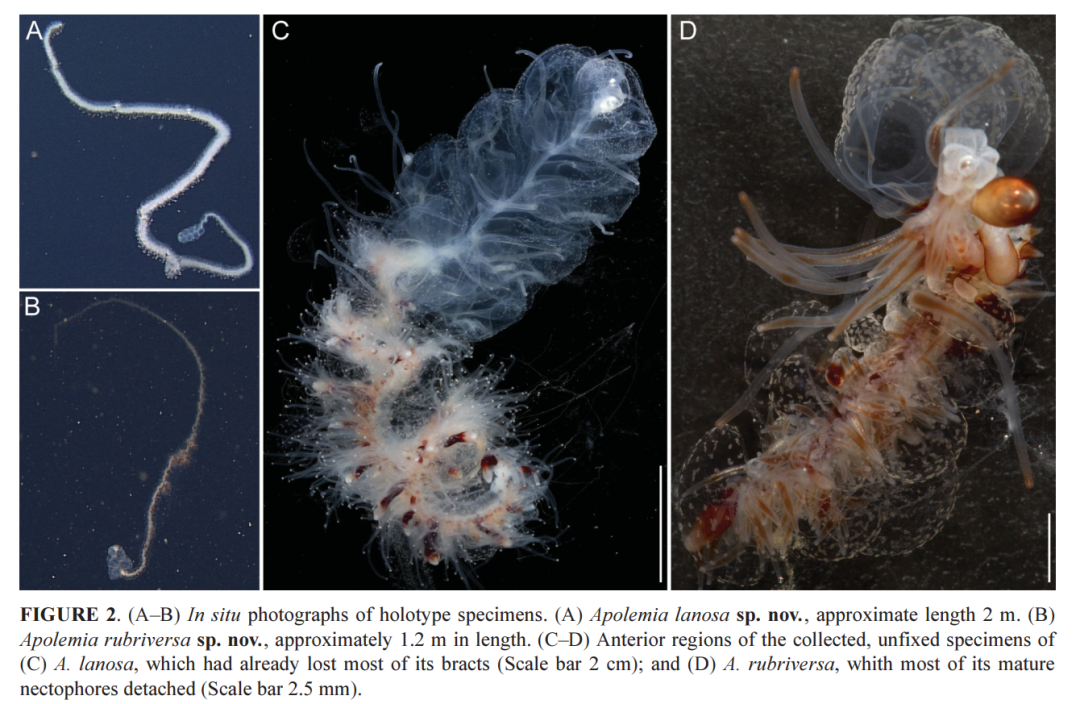
左侧为生活状态的管水母,“体长”可达数十米;右侧为群体端部的泳钟体[7],以及重复的身体结构的前一小段[4]
除了这些在好几个组织层次上似乎都可以作为有机体的生物,还有在每个层次上都不适合作为有机体的生物[2],比如从形态到遗传物质都非常动态的真菌[8][9]。
判断物质属于有机体还是环境同样会面临问题。如骨骼无疑会被认为是有机体的一部分,那外骨骼,外壳,一路过渡到无关生命维持的分泌物和附属物[10],也是如此吗?如果全部都算,那寄居蟹的壳和白蚁的巢恐怕也会被混为一谈了。
这些思考看起来是琐碎的,但它启发我们,有机体不仅是一个物质整体,也是功能整体;功能系统是一个广义的演化对象。在大多数时候,我们直观地使用有机体的概念,不会面临任何问题;但需要注意这个概念是动态与发展的。
从化学演化到最初的细胞,“生命分子”们经历了从环境物质到有机体组分的转变[11];从原核生物到真核生物,原先自由生活的细胞一起构成了更庞大复杂的整体;从单细胞到多细胞[12][13],生物在宏观尺度对“无尽之形”作了最壮美的诠释;在个体之上,还有无数精巧到让人怀疑演化真实性的种间互作现象[14][15],以及“超个体”与社会涌现出的个体无法企及的复杂行为[16]……笼统来说,有机体与环境系统的有利互作会在自然选择下强化,当互作双方和互作方式可以被编码在遗传里,它们就可能整合为复杂度更高的有机体的部分[17]。这一切无时无刻不在自然界上演着[18]。
这提示我们,研究有机体与环境首先要明确关注的对象与层次。扫清障碍后,我们便可以向生态位构建理论进发了。
人们早已认识到,生物会“智慧”地改造自然界。例如,河狸会用木、石和泥制造结构精巧、规模庞大的水坝,并世代继承维护,在给自己建后花园的同时,也为一大批沼泽生物创造了生境;大白蚁亚科(Macrotermitinae)物种会建造具有温湿度调节功能的土丘,通过改造土壤,搬运水分,改变地貌等方式,深度参与了某些稀树草原的环境塑造[19];织布鸟科(Ploceidae)物种能用草茎编织巧夺天工的悬挂式“别墅”;雨林树冠层的凤梨(Bromeliaceae)会用紧密排列的防水叶片,在叶心处积水以保存高空中稀缺的水和养料[20],也为众多蛙类和无脊椎动物提供了栖息地……

河狸和水坝
生态位构建:为统一生态与演化而生
对这些现象,以基因为中心的视角也作出过解释。这种视角在George C. Williams,WD Hamilton和Richard Dawkins等人的影响下逐渐丰满起来,并由后者所著的《自私的基因》(1976)和《扩展表型》(1982)等,变得家喻户晓。按照“自私的基因”观点,代际之间保持稳定的是基因,因此自然选择实际上作用于基因层面,而生物体的其他表现,从生理状态到行为,甚至于操纵别的生物所表现出的行为,都可以视为基因的表型。
例如,蛾子因基因表现出黑色或白色,鸟因基因而偏好筑黑色或白色的巢,这些性状都影响了承载基因的生物体的生存,因此,鸟巢可以算作鸟的“扩展表型”。
这套理论可以帮助理解从转座基因到上述环境改造案例在内的一系列现象的演化基础,但它仍有局限性。
例如,它把环境和有机体混为一谈,有时很难界定一个基因“表型扩展的边界”在哪里;它把基因间的互作过于简化,而河狸“筑坝”、白蚁“筑巢”这样的行为,恐怕很难归因于几个具体基因;它把没有直接反馈于基因的生命活动影响视为“副产物”,因此对某些实际上深刻影响地球演化进程的过程——如蓝绿藻在20多亿年前制造的“大氧化事件”——视而不见。

理查德·道金斯(Richard Dawkins),畅销书《自私的基因》的著者
因此,一批科学家开始致力于将生态学中“以有机体为中心”的视角,以及多年研究积累的丰富鲜活的案例,带入演化的理论框架。
其中,生态位构建理论(Niche construction theory, NCT)是一次重要尝试。
生态位是生态学中的重要概念。自1917年首次提出以来,它历经众多争论,但核心可以被简单概括为:能维持种群(或个体、物种)持续存在的生物和非生物环境因素[21]。
而同样的因素也左右着物种的演化。在《生态位构建》(2003)一书中,John Odling-Smee将生态位的演化效应称为“演化生态位”,并将其重新表述为:影响某个种群的选择压的总和[22]。
作为生态系统中能动而重要的组分,生物时刻在改变着自己或他人的环境,也即自己或他人的选择压。因此,生态位构建被定义为:造成与有机体互作环境发生改变的生命活动[22][23][24]。这里的有机体,不一定是该生命活动的主体;这里的互作环境改变,也不一定是通过复杂“构建物”来实现的,从迁徙到发育,都可以包含在内。
在这个定义下,讨论“什么属于生态位构建”似乎成了令人乏味的事:因为一个生物体几乎光是存在,就或多或少地参与生态位构建了。

John Odling Smee,2003年《生态位构建》的著者之一。但生态位构建的核心,即生物改造环境的思想,由来已久
那如此包罗万象的理论框架,有什么存在价值呢?它至少有两方面启发:强调了生物学中“互为因果”的思考方式;提示我们明确看问题的层次。
生态位构建带来了什么?
1. 互为因果
作为现代综论代表人物之一的Ernst Mayr曾以鸟类迁徙为例,指出理解一个生物现象需要区分其“远因”与“近因”[25]。“远因”解释了该现象为何如此,一般从演化的角度阐述其生物学意义;“近因”解释了该现象何以如此,一般从发育、行为角度阐述其实现机制。该思维模式对后世影响深远。
但扩展演化综论者认为,Mayr的这种区分,容易让人忽视“近因”对“远因”的影响。在他的鸟类迁徙案例中,“远因”涉及季节更替带来的环境变化,这确实不会被鸟类的迁徙行为改变;但在某些案例中,“近因”对“远因”的反作用是不可忽视的。
如鸟类复杂的求偶行为和夸张的附属构造,是雄鸟表型与雌鸟的喜好因适合度而协同变化的结果,并非雌鸟的偏好先出现,并从无到有“设计”了雄鸟的性状。除了性选择,类似的案例在协同演化、栖息地选择、频率依赖的选择等情境中不胜枚举[26]。因此,生物性状与选择压“互为因果”,即演化的“原因”与性状一起演化,应当是更普遍而有用的视角。

雄性蓝极乐鸟(paradisaea rudolphi)。这些华丽的鸟类,或许也突破人类的想象力了吧
生态位构建的框架,为关注这些“互为因果”关系中一度被忽视的“反作用”的研究领域提供了生长空间。
在远因-近因的区分下,发育结果(表型)才是重要的,表型是基因的映射,演化生物学家可以将发育视为黑箱,直接在基因和演化之间建立联系。而识别了生物对选择压的反作用后,发育偏好性和发育可塑性将直接影响演化轨迹。
例如,传统的理论会将非洲三湖慈鲷的趋同演化视为相似环境压力的结果,但慈鲷祖先的发育基础显然也起了作用。如一种“厚嘴唇”的趋同表型,可能是慈鲷侧扁的身形、吞吸式觅食方式与充满缝隙的碎石堆环境互作的结果;沿着类似的思路,或许能最终解释为什么湖中其他鱼类,没有经历大规模适应性辐射。
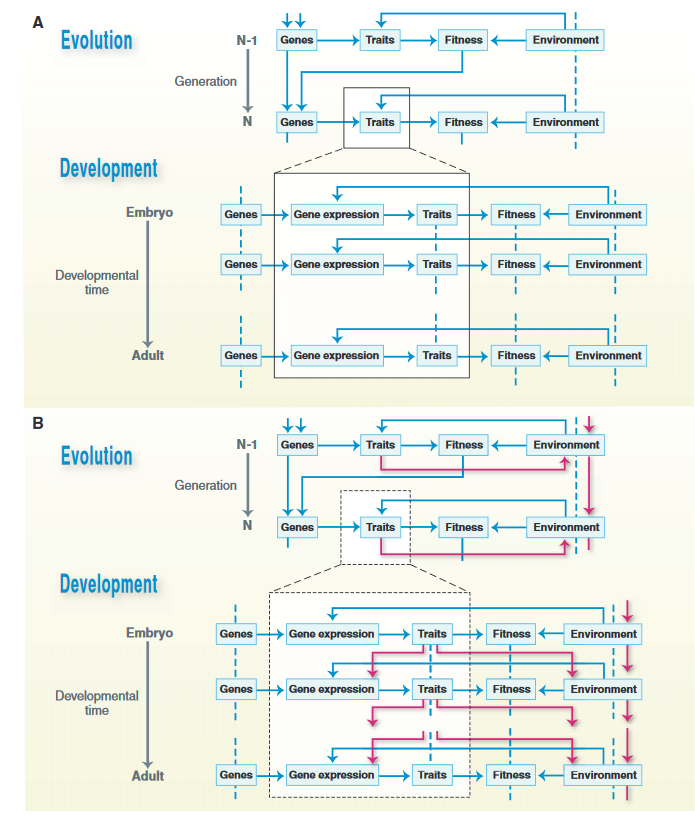
A.在忽视表型对环境反作用的情形下,环境如何随时间演化至此成了系统的外部变量,缺乏生物学意义。生物的性状影响下一代性状的方式只剩下遗传物质。因此,在研究演化时,发育可以被视为黑箱。B.扩展演化综论强调发育和行为对环境的反作用[26],从而将发育和生态的事实纳入进来。
文化遗传也是一种生态位构建。人类发展为农耕文明后,生活环境和生产方式发生巨大变化,包括定居,食用驯化后的动植物等等。这种文化,一方面放松了对某些基因的选择,一方面加强了对淀粉消化、蛋白代谢等方面基因的选择。
然而,文化遗传通常伴随着后天学习行为,这对神经系统的复杂程度提出了要求,因而不能随意套用。比如,对种植真菌的大白蚁来说,“农业”更多地是一种编码于神经连接组内的本能行为,是无数代个体与环境互作并得到选择固定的结果。而人类的学习,相当于在一代时间内,利用个体与周遭环境(包括其他个体)的互作在脑内建立经验模型[27],大大提升了人的适应性。
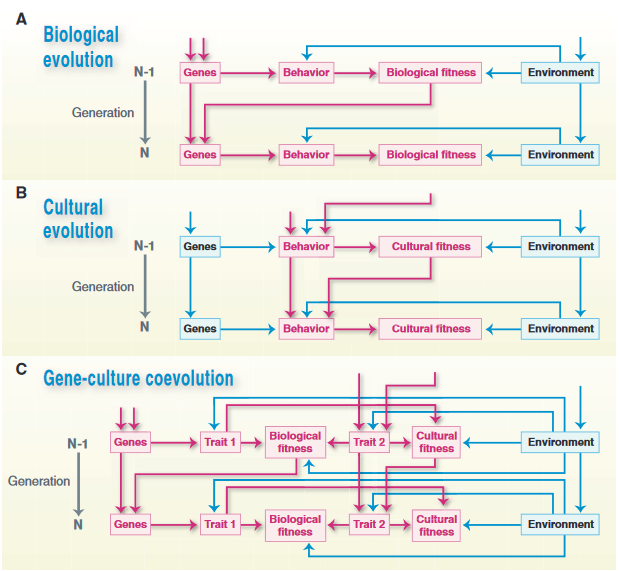
通过基因遗传的行为性状(A)与通过文化遗传的行为性状(B)共同演化(C)。这里为了简洁而省略了与环境的交互。
可见,扩展演化综论的一系列主张,从生态位构建,到发育偏好,表型可塑性,再到包括文化遗传在内的“包容性遗传”【EES讨论第二期】,是紧密联系,不可分割的。其背后的核心理念,便是“互为因果”——要求科学家们以一个更全面的视角,审视这个在紧密联系中不断演进的自然界。
2. 层次
正如开篇所提到的,生态位构建启发我们重新审视“有机体”和“环境”的定义与关系,并惊讶地发现,这个视角的适用性是如此之广。
比如,癌细胞可以被视为细胞层面的“有机体”,而促进血管新生,创造具有低氧、免疫抑制等条件的肿瘤微环境,就属于它的“生态位构建”。事实上,不同个体独立发展出的肿瘤拥有一系列“综合征”(hallmarks of cancer),本身便是适应与“趋同演化”存在的证据[28][29]。或许有人无法接受体细胞作为“有机体”的视角,认为它不过宿主短暂一生中的副产物,那不妨看看袋獾(Sarcophilus harrisii)中通过撕咬而传播的面部肿瘤吧[30][31]——只要能找到适宜的环境,演化的洪流便势不可挡。
结语
如果绘制这样一片适合度景观:xy代表不同性状的度量构成的“表型平面”,z轴代表该表型下,某有机体在某环境中的适合度,那么传统演化识别的是该有机体被自然选择推向高点的过程。
而扩展演化综论则要我们更多地注意到,这片景观还有其它性质:它就像蹦床一样,是随生物的移动而运动的(生态位构建);生物向不同方向运动是有难易差别的(发育偏好性和可塑性)……对这片景观的匆匆一瞥不可能抓住它的所有性质,但一代又一代耕耘于各个领域的生物学家,将在探索中发现越来越不起眼的细节,并拼凑出有关演化——这场奇迹般的盛大演出的宏伟图景。
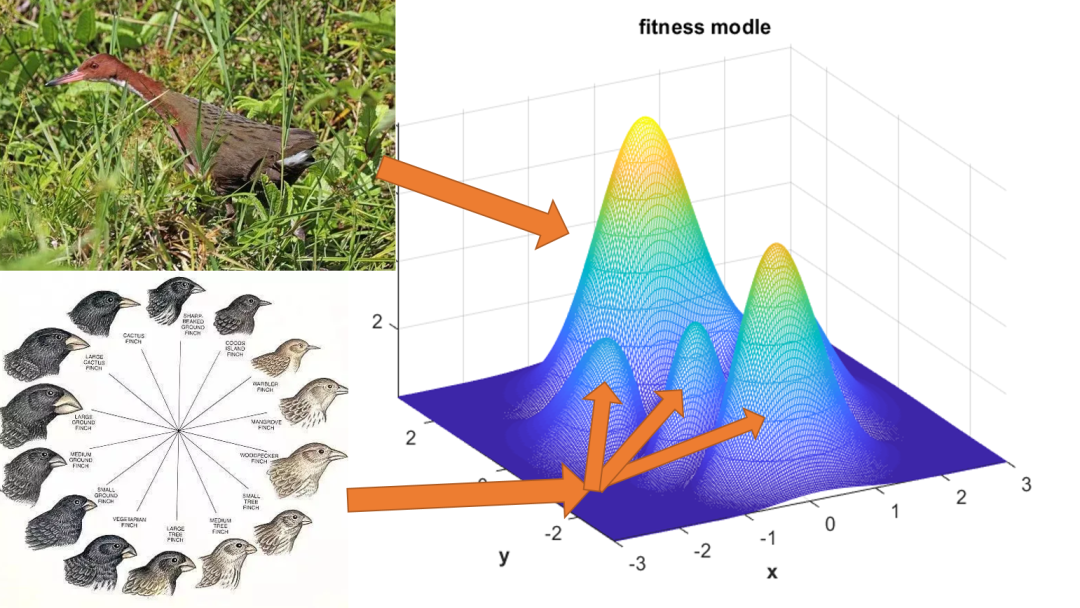
在两次迁入事件中重复演化出飞行退化表型的白喉秧鸡[32](Dryolimnas cuvieri,左上),和作为适应辐射案例而为人熟知的达尔文雀(左下)。它们是叙述传统演化故事的完美对象
在这场有关扩展演化综论的变革中,没有理论的对立,只有看问题的不同视角。虽然无论如何,具体的工作仍将继续[33][34],但关于这些视角的梳理与思辨,或许总会在某一时刻,照亮那些我们“知道”但未曾注意过的事实。
参考文献
[1] Smocovitis V B. Unifying biology: The evolutionary synthesis and evolutionary biology[J]. Journal of the History of Biology, 1992, 25(1): 1–65.
[2] Pepper J W, Herron M D. Does Biology Need an Organism Concept?[J]. Biological Reviews, 2008, 83(4): 621–627.
[3] Wilson J A. Ontological Butchery: Organism Concepts and Biological Generalizations[J]. : 11.
[4] Siebert S, Pugh P R, Haddock S H D. Re-evaluation of characters in Apolemiidae (Siphonophora), with description of two new species from Monterey Bay, California[J]. Zootaxa, 2013, 3702(3): 201.
[5] Boomsma J J, Gawne R. Superorganismality and caste differentiation as points of no return: how the major evolutionary transitions were lost in translation: Superorganisms, eusociality and major transitions[J]. Biological Reviews, 2018, 93(1): 28–54.
[6] Munro C, Zapata F, Howison M, et al. Evolution of Gene Expression across Species and Specialized Zooids in Siphonophora[J]. R. Rogers. Molecular Biology and Evolution, 2022, 39(2): msac027.
[7] 动物志. 管水母:无数微小个体合体,造就了世界上最长的动物[J]. 2020.
[8] Du X-H, Yang Z L. Mating Systems in True Morels ( Morchella )[J]. Microbiology and Molecular Biology Reviews, 2021, 85(3): e00220-20.
[9] Brasier C. A champion thallus[J]. Nature, 1992, 356(6368): 382–383.
[10] Argonaut[J]:https://en.wikipedia.org/wiki/Argonaut_(animal)
[11] Larkum A W D. The Evolution of Chlorophylls and Photosynthesis[A]. 见: B. Grimm, R.J. Porra, W. Rüdiger, et al. Chlorophylls and Bacteriochlorophylls[M]. Dordrecht: Springer Netherlands, 2006, 25: 261–282.
[12] Knoll A H. The Multiple Origins of Complex Multicellularity[J]. Annual Review of Earth and Planetary Sciences, 2011, 39(1): 217–239.
[13] Sebé-Pedrós A, Degnan B M, Ruiz-Trillo I. The origin of Metazoa: a unicellular perspective[J]. Nature Reviews Genetics, 2017, 18(8): 498–512.
[14] Mayer V E, Frederickson M E, McKey D, et al. Current issues in the evolutionary ecology of ant–plant symbioses[J]. New Phytologist, 2014, 202(3): 749–764.
[15] de Bekker C. Ophiocordyceps–ant interactions as an integrative model to understand the molecular basis of parasitic behavioral manipulation[J]. Current Opinion in Insect Science, 2019, 33: 19–24.
[16] Kronauer D J C. Army Ants: Nature’s Ultimate Social Hunters[M]. Harvard University Press, 2020.
[17] Szathmáry E, Smith J M. The major evolutionary transitions[J]. Nature, 1995, 374(6519): 227–232.
[18] Del Valle R P, McLaughlin R N. Stealing genes and facing consequences[J]. Science, 2022, 378(6618): 356–357.
[19] Chouvenc T, Šobotník J, Engel M S, et al. Termite evolution: mutualistic associations, key innovations, and the rise of Termitidae[J]. Cellular and Molecular Life Sciences, 2021, 78(6): 2749–2769.
[20] Ashley Meyers. The leaves of some bromeliads capture water and nutrients in a storage tank via hydrophobic leaf surfaces[J]. 2017.
[21] Trappes R. Defining the niche for niche construction: evolutionary and ecological niches[J]. Biology & Philosophy, 2021, 36(3): 31.
[22] Odling-Smee F J, Laland K N, Feldman M W. Niche construction[A]. 见: Niche Construction[M]. Princeton university press, 2013.
[23] Niche construction[J]:https://en.wikipedia.org/wiki/Niche_construction
[24] Kevin N Laland. Defining niche construction[J]. 2017.
[25] Mayr E. Cause and Effect in Biology: Kinds of causes, predictability, and teleology are viewed by a practicing biologist.[J]. Science, 1961, 134(3489): 1501–1506.
[26] Laland K N, Sterelny K, Odling-Smee J, et al. Cause and Effect in Biology Revisited: Is Mayr’s Proximate-Ultimate Dichotomy Still Useful?[J]. Science, 2011, 334(6062): 1512–1516.
[27] 何静. 预测加工:群体智能研究的新范式[J]. 社会科学, 2022: 29–34.
[28] Fortunato A, Boddy A, Mallo D, et al. Natural Selection in Cancer Biology: From Molecular Snowflakes to Trait Hallmarks[J]. Cold Spring Harbor Perspectives in Medicine, 2017, 7(2): a029652.
[29] Lloyd M C, Cunningham J J, Bui M M, et al. Darwinian Dynamics of Intratumoral Heterogeneity: Not Solely Random Mutations but Also Variable Environmental Selection Forces[J]. Cancer Research, 2016, 76(11): 3136–3144.
[30] Margres M J, Ruiz-Aravena M, Hamede R, et al. Spontaneous Tumor Regression in Tasmanian Devils Associated with RASL11A Activation[J]. Genetics, 2020, 215(4): 1143–1152.
[31] Patton A H, Lawrance M F, Margres M J, et al. A transmissible cancer shifts from emergence to endemism in Tasmanian devils[J]. Science, 2020, 370(6522): eabb9772.
[32] Hume J P, Martill D. Repeated evolution of flightlessness in Dryolimnas rails (Aves: Rallidae) after extinction and recolonization on Aldabra[J]. Zoological Journal of the Linnean Society, 2019, 186(3): 666–672.
[33] Stephen Buranyi. Do we need a new theory of evolution?[J]. 2022.
[34] Jerry Coyne. Once again: A misguided article on why the theory of evolution is obsolete[J]. 2022.










