“我即是虫群”?以“超个体”的视角看待蚁群
相传在白垩年间 ,有一窝刚刚羽化成虫的蝼蚁,看着巢穴外恐龙横行的危险丛林,想到不久便要各奔东西,白手起家生儿养女,便破防了,边哭边呜咽道:“太弱小了,没有力量……”突然,有虫字正腔圆地说:“妹妹们,我们联合!”于是乎,第一批蚂蚁诞生了,从此在全球各大陆地生态系统中攻城略地,一举成为最繁盛的社会性昆虫之一……
“妹妹们“(无端联想),来源:《超炮S》
以上内容,多半不是真的。但千百年来,蚂蚁复杂精妙的合作形式确实令达尔文在内的许多生物学家既爱又“恨”——曾经独居的昆虫,怎么就自发生活在了一起呢?甚至有个体愿意为了集体牺牲自己的一切,这和强调个体争夺繁殖能力的“自私”的自然选择相违背吗?
1910年 ,美国昆虫学家惠勒(William Morton Wheeler)为这个问题提供了一个全新视角 。他说:“大家都别争,咱把蚁群看作一个生物体,蚁后(繁殖品级)是生殖细胞,负责延续香火,工蚁(劳工品级)是体细胞,负责维持蚁群的‘生命’,这样就好理解多了。”此语一出,四座皆惊,以为妙绝。

William Morton Wheeler,来源:维基百科
回想多细胞生物是如何产生的?一精一卵结合,而后受精卵再分裂分化出多个细胞,其中一部分分化为新的生殖细胞,而其他的则发育为体细胞。所有的细胞均是受精卵的克隆产物,继承了相同的遗传物质,因此只要保证生殖细胞获得繁殖机会,等同于体细胞携带的遗传物质也能传递给后代——也即所有细胞都得了自然选择的好处,雨露均沾嘛!由此及彼,蚂蚁最初很可能是一夫一妻的结合 ,剩下的个体全是这受精蚁后的子女。小家庭之内,大家遗传相似性很高,帮助姐妹就相当于帮助自己,也没必要计较得失了。因此,蚂蚁间的合作越来越紧密复杂,直至今日有些蚂蚁物种甚至发展出了由上百万个个体组成的蚁群。为了加深大家的印象,惠勒创造了“超有机体”一词,不仅强调了蚁群与多细胞生物个体的诸多相似性,也体现了对蚂蚁之类的社会性昆虫由衷的欣赏与赞叹。
但是,一百多年来,“超有机体”有关的概念更多只是思想实验,没有足够的数据支撑。蚁后和工蚁同样拥有二倍体基因组,却为何一个最终加冕,一个劳作一生?作为“超有机体”的基本单元,蚂蚁个体的发育过程,和细胞的发育过程有几分相似?是否有相似的调控规律?诸如此类的关键问题,一直无人解答。如今,在“单细胞测序研究个体发育”的方法论的启发下,科学家们利用成熟的转录组测序和分析手段,在前所未有的广度上对“超有机体”的“发育过程”做了注释,试图揭开这一“生命的更高组织形式”的神秘面纱。
两种“超个体”
本研究选择法老蚁(Monomorium pharaonis)和一种顶切叶蚁(Acromyrmex echinatior)作为模式物种。

法老蚁

顶切叶蚁,来源:AlexWild
这两种蚂蚁虽然外表迥异,实际上同属于切叶蚁亚科这一大家庭。但它们也谈不上多近的亲戚。前者是小家蚁属的一员,顾名思义,它们个体微小,而且随遇而安(在研究人员的咖啡机里,也能过得有滋有味),已经随着人类活动散布到世界各处,成为常见的室内害虫。后者是狭义切叶蚁的一支——就是那些经常出现在科普文章里,切叶子,种蘑菇,建地下城堡的家伙。
在发育上,它们各有各的特点:法老蚁工蚁还在娘胎里就被贴上了“打工人”的标签——在早期胚胎发育阶段,工蚁就失去了卵巢,发育命运已经确定——这么早就被安排得明明白白,在蚂蚁里都属罕见;顶切叶蚁的工蚁则有大小和形态各异的亚品级,有的发育为娇小的“园丁”,有的则成为顶着大脑袋的“活体割草机”,这类蚂蚁的分工被认为是在幼虫期才开始确立。将这两种迥异的蚂蚁的研究结果综合起来,有利于发现控制品级分化的保守基因。
“超个体”的发育蓝图
为了高分辨率地解析两种“超有机体”的发育过程,研究人员决定从不同发育时期的蚁后和工蚁的转录组入手。转录组反映了个体所有细胞内表达的RNA的种类与数量信息,可以作为它当前生命活动的“快照”。“快照”之间的相似度越高,说明个体之间发育状态越接近。以法老蚁为例,研究人员“拍摄”了它从卵到成虫共16个阶段的“照片”。根据这海量的数据,研究人员生成了“超有机体发育图谱”。正如预期的那样,蚁后和工蚁在最初非常相似,在成长过程中慢慢分离开来。
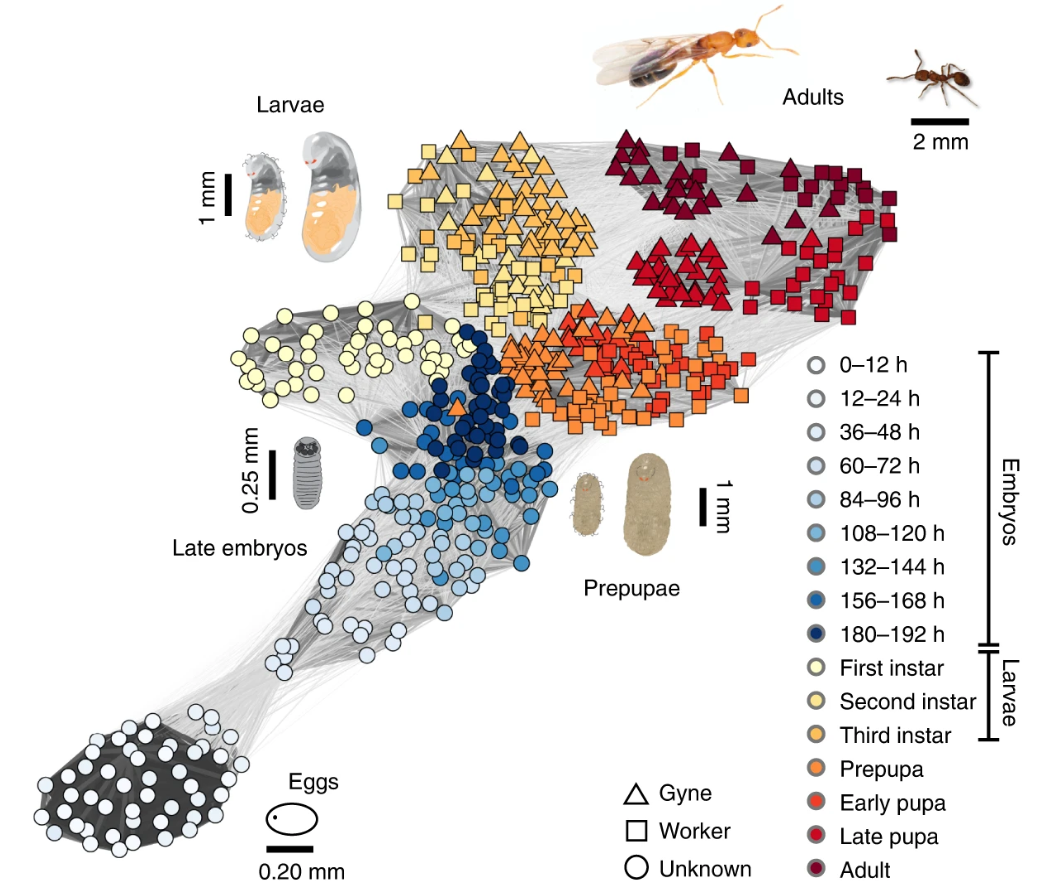
“超有机体发育图谱”
在一龄幼虫及以前,法老蚁的“皇室”和工蚁如此相像,以至于很难用肉眼通过体表特征来区分,这为研究发育早期的品级分化调控带来了极大的困难。为此,研究人员基于“相邻发育阶段,具有近似的主导调控基因”这样朴素的思想,利用转录组整体数据,开发了“逆向预测算法(BPA)”,基于个体的表达图谱对个体所属品级进行预测。经检验,这个算法首次在蚂蚁发育早期实现了精确品级预测,为日后更深入的研究打下基础。
尽可能补全了个体的身份信息后,研究人员对两个物种幼虫阶段的基因表达动态做了初步分析。有趣的是,蚁后和工蚁的很多区别反映在保幼激素(JH)信号通路上。保幼激素可谓昆虫生理学中的明星分子,它最为人熟知的功能就是抑制昆虫蜕皮,使之维持幼态。然而,在社会性昆虫中,保幼激素却和品级分化扯上了关系:高浓度的保幼激素作为关键信号,使个体发育为皇室品级 。
研究人员检测到,保幼激素合成与响应的关键基因的表达量在蚁后幼虫阶段中降低得更晚,而分解保幼激素的基因在蚁后幼虫阶段中表达更少。这一切都使蚁后得以维持更高的保幼激素浓度,从而相比工蚁获得了额外的发育时间,有更长的幼虫发育期。而工蚁则早早进行变态发育,由幼虫化为蛹。最终,工蚁在羽化成虫后,不仅个头小,也没有单眼、翅等器官,一副“发育不良”的模样。如果给工蚁幼虫“嗑药”,人工增加它体内的保幼激素,则工蚁也能发育为形似蚁后的“中间个体”——只是早期退化的卵巢已不能无中生有了。这体现了保幼激素在品级分化中的关键地位,及其演化上的保守性。
发育的“渠化”现象
早在分子生物学革命之前,发育生物学家沃丁顿就对个体发育做过一个绝妙的比喻,即沃丁顿表观遗传景观(waddington epigenetic landscape)。
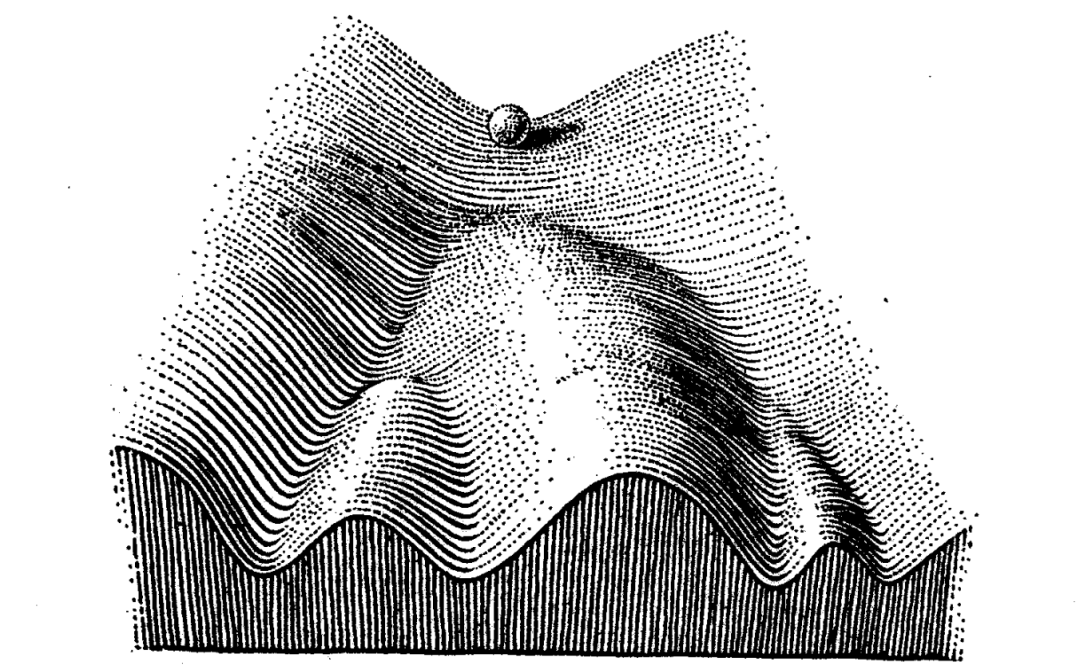
沃丁顿表观遗传景观
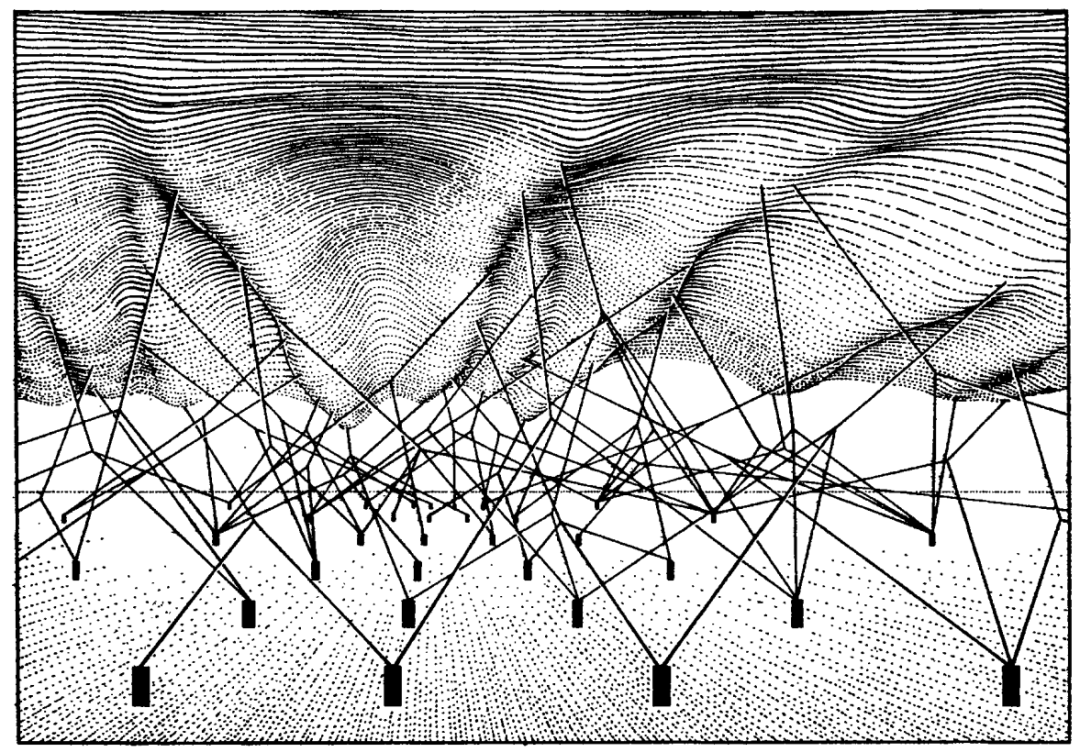
他把每个细胞比作一个从山顶沿沟壑滚下的石球——这些沟壑便是既定的发育路径,石球停在山脚的位置代表最终的表型。当细胞处于山顶,理论上可以进入任何发育路径;当它向下滚动,因为沟壑间的壁垒还不明显,轻微的扰动就能使它切换路径;但随着发育的进行,转换变得不那么容易,它通常只能一路向前,最终落在一个可预测的位置。这一认识,和未来建立的“分化水平越高,全能性越低”的细胞分化基本范式相吻合。除此之外,“停在可预测的位置”保证了细胞不会分化成奇奇怪怪的中间形态。确保细胞发育的结果精确可重复,且具有一定的抗干扰能力,对多细胞个体的生存是非常关键的。为了形象地描述这一点,沃丁顿专门拟了个词——“渠化”(canalization) 。
在微观上,渠化实际表现为一系列特定基因的次序表达。就好像在这片“景观”之下,有很多“铆钉”(基因)固定着“绳索”(基因的表达产物,或它们的效应),它们的牵引使景观凹凸不平,形成一条条发育通路。
个体发育中的“渠化”,早已得到检验。那么“超有机体”的发育是否同样是“渠化”的过程?理论上说是的,不然,蚁群中将无法辨识出有显著区别的两个品级,只有一系列表型、繁殖力连续变化,各不相同的过渡个体。研究人员利用每个基因在发育过程中的表达图式,建立了一套算法用以量化定义“渠化系数”,这个系数越高,说明这个基因在发育过程受到的“渠化”约束力越大,也说明这个基因在长期自然选择下,形成了固定的表达模式。用这套方法研究人员筛选了表达模式和“渠化”过程最相符的基因——即表达水平的差异随着发育的进行,在品级间增大,在品级内减小。按这种方法,研究人员在法老蚁中锁定了一个最显著的渠化基因,这一基因的功能从未被报道过。研究人员并将其命名为“Freja”。
“丰饶女神”
芙蕾雅(Freja)是北欧神话中掌管魔法,爱情和生育的女神。巧妙的是,以她命名的基因或许就是蚁后获得超强生育力的密码。
Freja是膜翅目昆虫特有的基因。它可能编码一个信号肽,从二龄幼虫开始就在法老蚁后体内高表达,成年后主要在其卵巢滤泡细胞内表达。难道Freja就是为蚁后“加冕”的幕后推手?
一如科学家所料,在幼虫期间敲低Freja的表达量,果然能将未来的“皇后”贬为“庶民”——实验处理的个体普遍失去单眼和健全的翅,体型也缩水不少。即使在已经正常羽化的成虫中敲低Freja,也能大大降低蚁后卵巢的活跃程度,进而影响繁殖力。如此看来,Freja确实是蚁后“渠化”的发育过程中一个重要的调控因子,并且直接影响了她的生育能力。
然而,在法老蚁和顶切叶蚁中具体受到渠化约束的基因并不完全一致。比如在后者中,Freja并不是一个明显渠化的基因。原来,虽然顶切叶蚁的工蚁没有交配的能力,但它们依然会发育出作为遗痕器官的卵巢。这提示我们,蚂蚁品级分化的问题,或许比想象中复杂很多。作为一个起源于约一点四亿年前,拥有一万五千多个现存成员的庞大家族,这些繁荣于千差万别的自然环境中的“超有机体”们,或许在品级分化这一“祖传”的演化创新之上,又自己发展了形形色色与之配套的表型。
本研究成果近日以“Canalized gene expression during development mediates caste differentiation in ants”为题发表于《自然:生态与演化》(Nature Ecology & Evolution)上。丹麦哥本哈根大学的博士后研究员邱必涛和昆明动物研究所的博士生戴学勤为本文的第一作者。哥本哈根大学的Jacobus Boomsma教授,浙江大学生命演化研究中心的张国捷教授等为论文的共同通讯作者。该项研究工作受到国家自然科学基金委、伦德贝克基金会(Lundbeck Foundation)等资助。
参考文献
1. Phillip Barden, “Fossil Ants (Hymenoptera: Formicidae): Ancient Diversity and the Rise of Modern Lineages,” n.d., 30.
2. William Morton Wheeler, Ants: Their Structure, Development and Behavior (Columbia University Press, 1910).
3. William Morton Wheeler, “The Ant-Colony as an Organism,” Journal of Morphology 22, no. 2 (June 1911): 307–25, https://doi.org/10.1002/jmor.1050220206.
4. Jacobus J. Boomsma and Richard Gawne, “Superorganismality and Caste Differentiation as Points of No Return: How the Major Evolutionary Transitions Were Lost in Translation: Superorganisms, Eusociality and Major Transitions,” Biological Reviews 93, no. 1 (February 2018): 28–54, https://doi.org/10.1111/brv.12330.
5. Daniel J C Kronauer, Army Ants: Nature’s Ultimate Social Hunters (Harvard University Press, 2020).
6. Carolina Gonçalves Santos, Fernanda Carvalho Humann, and Klaus Hartfelder, “Juvenile Hormone Signaling in Insect Oogenesis,” Current Opinion in Insect Science 31 (February 2019): 43–48, https://doi.org/10.1016/j.cois.2018.07.010.
7. Waddington, C. H., “Canalization of Development and the Inheritance of Acquired Characters,” Nature, 1996.











