实验演化——为演化按下“快进键”
海洋中的鱼类在漫长的岁月中演化出鳞片,这些鳞片不仅为它们提供了抵御捕食者的保护,还使它们在水中滑行得更快。同样,大象的长鼻子逐渐演化出来,帮助它们更加灵活地觅食、饮水,还能作为一种工具来移动物体。蝙蝠的翅膀起源于远古哺乳动物的前肢,赋予它们飞翔和在夜空中捕捉昆虫的独特能力。此外,鸟类的喙形状各异,完美适应了不同的食物来源,比如啄木鸟坚硬的喙就像是大自然的钻头,能够轻松凿开树皮寻找昆虫。这些例子展现了自然界中演化的奇妙与多样性。然而,演化的过程往往缓慢而漫长,以至于我们难以在一生中亲眼目睹这些变化。

图1 不同生物的适应性演化。图片来源Shutterstock,BBC Wildlife Magazine,Forbes.
有没有想过,如果可以按下“快进键”,亲眼目睹演化的发生会是什么样子?
实验室演化(Experimental Evolution)正好为我们提供了这种可能性。通过在受控环境下对生物施加特定的选择压力,人们能够在短时间内观察到生物适应性的快速演化。这种方法可以模拟不同环境下的生物演化过程,帮助人们揭示自然选择的奥秘。打个比方,科研人员就像“导演”,为一些“演员”——可以是动物、植物或微生物,设置了不同的“剧本”,让它们在各种苛刻的环境下“表演”。这些环境可能包括极高的温度、致命的毒素等等。借此,人们可以观察这些生物如何“调整”自己,以适应这些新的挑战。这个“剧本”的背后,是生命演化的核心:自然选择。
实验室演化作为一种强大的研究工具,已经在多个领域得到了广泛应用,从基础科学研究到实际应用,各个方面都展现出了其巨大的潜力。
演化的“高速公路”:探秘单细胞到多细胞生物的演化
如前所述,演化通常是一个缓慢的过程,尤其是单细胞到多细胞生命形式的演化。这一转变往往需要数亿年的时间,通过微小变化的积累、环境的适应以及物种的分化,最终才得以呈现。为了观察多细胞生命是如何演化的,佐治亚理工学院William Ratcliff团队启动了一个多细胞长期演化实验(MuLTEE:multicellularity long-term evolution experiment),成功在实验室中经过3000代重现了单细胞祖先到多细胞生物的演化过程1,2。
研究的主角是人们熟悉的酵酒酵母(Saccharomyces cerevisiae),通常情况下,这些微小的单细胞生物是以独立个体的形式存在的。研究人员进行一种典型的定向选择(directional selection)实验方式:让酵母在培养液中沉降,然后每次都挑选那些沉得最快的酵母进行下一轮繁殖。由于“多细胞”的菌群沉降得更快,酵母菌逐渐演化出了多细胞的形态——这些酵母细胞彼此黏在一起,形成了类似“雪花”的结构,被称为雪花酵母(snowflake yeast)。
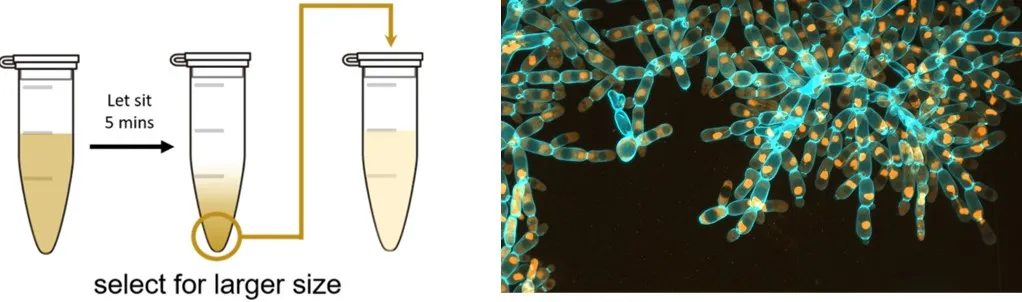
图2 左图:定向选择实验示意图;右图:雪花酵母。 图片来源:乔治亚理工学院。
起初,雪花酵母的细胞变得更加细长,减轻了细胞密集排列时产生的应力。随着时间的推移,这些细胞的分支开始交错在一起,即使许多细胞连接断裂后,整个群体仍能保持完整。这种结构的变化使得这些酵母群体形成了体型比祖先大2万多倍的大型多细胞体——体型类似于一只果蝇的大小,包含超过50万个细胞。不仅如此,雪花酵母还演化出了新的材料特性:它们开始物理强度比明胶还弱,经过演化后,变得像木材一样坚固和坚韧。这项研究在2023年5月发表在《自然》杂志上,作者William Ratcliff也表示这个工作只是漫长故事的第一章,他们将继续利用MuLTEE来研究多细胞生物的演化。

图3 上图:雪花酵母从每簇约100个细胞(左管)演化到每簇近50万个细胞(右管)
适应与妥协的“交易”:为什么适应经常伴随着权衡(trade-off)?
当人们想到适应性演化时,常会浮现出那些在特定环境中表现卓越的“演化明星”案例——比如仙人掌的节水本领、细菌的抗药性等。这些在特定环境中表现优异的物种,似乎总能找到最合适的生存方式。然而,这些令人惊叹的特征背后,往往伴随着不可避免的“权衡”:在某些环境中能够增强生存能力的特征,可能会在其他情境中带来负面影响。比如,虽然仙人掌针状叶子可以减少水分蒸发并防止食草动物的侵害,但它们也限制了仙人掌进行光合作用的能力,使得它们在生长和繁殖上更加缓慢;演化出抗生素耐药性的细菌往往需要付出代价,因为赋予抗药性的基因突变可能会减慢细菌的生长速率,使得在没有抗生素的环境中,耐药菌株难以与非耐药菌株竞争。
这种适应与妥协的“交易”可以在实验室演化中被科学家们清晰地揭示出来。例如,达尔豪斯大学的Michael Rose通过实验演化来研究果蝇的衰老与生育能力之间的权衡3。研究人员从一群果蝇(Drosophila melanogaster)中筛选出那些在老年仍然能繁殖的个体,经过多代选择,培养出了一群寿命显著延长的果蝇。乍看之下,这似乎是一场“长寿革命”,但事实证明,虽然这些果蝇在老年依然保持了生育能力,但在年轻时,它们的生育力却有所下降——这正是寿命延长与生育力之间的“权衡”。
通过这样的实验室演化研究,我们得以窥见自然选择在微观世界中的运作方式。这种“实验室快进”让科研工作者得以快速探索生命演化的奥秘,揭示生物体在适应环境的过程中如何在优势与劣势之间做出妥协。
瓶子里的演化史:演化中的“意外惊喜”
在演化生物学领域,来自美国密歇根州立大学的Richard E. Lenski几乎无人不晓。此前有人称他为——“将演化史装进瓶子里的人(The Man Who Bottled Evolution)”4, 那是因为他的实验室演化实验在该领域有着非凡的影响力。时间回到1988年,当时Lenski做了一个看似简单的实验:他将12组大肠杆菌放入烧瓶中,在37℃的条件下摇匀过夜。瓶中的营养只够它们生长一天,接下来第天他都需要从瓶中取出定量的菌液,转移到一个全新的培养基中,重新培养。如此循环往复,日复一日,一直持续了30多年。样品每隔75天便被冷藏起来,以便追溯演化背后的变异机制5。

图4 时光旅行者——Richard E. Lenski和他的12株大肠杆菌。图片来源:G. L. KOHUTH, BRIAN BAER AND NEERJA HAJELA /密歇根州立大学。
在数万代的演化后,细菌并没有“按部就班”地演化,而是上演了一场令人惊讶的“柠檬酸大逆袭”。自然界中,大肠杆菌在有氧条件下无法代谢柠檬酸,但在Lenski的实验中,经过3万多代的演变后,12个种群中有一个竟然打破了这一常规,成功地利用柠檬酸作为能源。然而,这个现象并不是一夜之间的结果,而是多个突变逐步积累的结晶。研究显示,柠檬酸代谢能力的出现依赖于之前的演化变化,这就像是某种“演化拼图”,只有在所有碎片到位时,新功能才能“拼”出来。

图5 堆积如山的平板。Zachary Blount 利用这些培养皿研究了细菌如何演化出利用柠檬酸的能力。图片来源:Brian Baer/密歇根州立大学。
实验室演化的应用
抗药性是现代医学面临的一个重大挑战。病原体在暴露于抗生素的环境下,能够通过突变和选择迅速演化出抗药性。实验室演化为研究这一过程提供了独特的视角。人们可以在受控环境下模拟细菌与抗生素的长期接触,观察它们如何演化出抵抗能力。同样,实验室演化可以用来研究肿瘤细胞如何在化疗药物的压力下演化出抗药性,从而帮助开发更有效的癌症治疗方法。
工业微生物在酿造、制药、生物燃料生产等领域中扮演着重要角色。通过实验室演化,科学家们可以优化微生物的特定功能,使其在工业应用中表现出更高的效率和产量。例如,在生物燃料的生产中,研究人员可以通过实验室演化,筛选出能够更高效利用植物纤维素的微生物,从而提高生物燃料的产量和可持续性。同样,实验室演化还可以用来改进酵母菌株,使其在啤酒酿造过程中产生更丰富的风味化合物。
实验室演化也为农业提供了新的思路。通过模拟自然选择的过程,研究人员可以在实验室中快速筛选出具有优良性状的农作物或牲畜品种。例如,通过实验室演化,科学家可以培育出抗逆性更强的农作物,能够在极端气候条件下依然保持高产量。
人工生命的实验演化
除了研究生物体的自然演化,科学家们还在实验室中创造了“人工生命(Artificial Life)”,即通过计算机模拟生命系统来研究生命的起源和演化过程。一个著名的研究平台是Avida,由密歇根州立大学开发的开源演化计算平台6。Avida支持对生命的基因属性进行模拟,如繁殖、变异、竞争和合作等,进而帮助研究者观察复杂的生命现象。Avida的主要功能包括模拟数字有机体的自我复制、突变和自然选择过程,提供多种环境条件(如食物资源、物理环境等),支持对数字有机体行为进行编程,并能够记录有机体的表现进行详细的统计分析。这些功能使Avida成为研究演化动态和遗传机制的强大工具。
实验室演化的局限性
虽然实验室演化在很多方面都非常有用,但它也有一些局限性。首先,实验室环境往往非常简化,与自然环境有很大不同。这可能导致实验结果在自然界中并不完全适用。其次,实验室演化通常涉及较小的种群规模和较短的时间跨度,而自然演化往往发生在大型种群和更长的时间尺度上。此外,实验室演化的结果有时也可能受到“人工选择”的影响,即实验设计可能会引入偏差,导致某些特定的演化结果。科研人员必须小心地设计实验,并在解释结果时考虑这些潜在的局限性。
实验室演化为我们提供了一个独特的视角,能够在相对较短的时间内观察演化的过程。这种方法不仅帮助我们理解了生命的基本原理,还在医疗、工业和技术领域展示了广泛的应用前景。尽管存在一些局限性,实验室演化仍然是揭示自然界中复杂演化现象的强大工具。通过不断的研究和技术进步,我们将能够进一步解锁演化的秘密,并将这些发现应用到更广泛的领域中。
参考文献
1. Bozdag, G. O. et al. De novo evolution of macroscopic multicellularity. Nature 617, 747-754 (2023).
2. Ratcliff, W. C., Fankhauser, J. D., Rogers, D. W., Greig, D. & Travisano, M. Origins of multicellular evolvability in snowflake yeast. Nature communications 6, 6102 (2015).
3. Rose, M. R. Laboratory evolution of postponed senescence in Drosophila melanogaster. Evolution, 1004-1010 (1984).
4. Pennisi, E. (American Association for the Advancement of Science, 2013).
5. Lenski, R. E. Experimental evolution and the dynamics of adaptation and genome evolution in microbial populations. The ISME journal 11, 2181-2194 (2017).
6. Lenski, R. E., Ofria, C., Pennock, R. T. & Adami, C. The evolutionary origin of complex features. Nature 423, 139-144 (2003).










