当代生物哲学研讨会(八)生物功能的演化起源
【提示:快速浏览完这篇文章大概需要10分钟,带着思考大概需要20分钟。这个问题还有许多未解之谜,如果你有兴趣更深入思考,也许值得投入你一辈子的时间。】
从打磨石器到冶铁炼钢,从轮船火车到智能设备,沿着人类的发展轨迹,我们能看到祖先们如何利用智慧巧思,发明出越来越多复杂精巧的人造设备。无论是为了除草而发明的除草机,为了打开罐头而发明的开瓶器,哪怕像手机电脑这样的精密电子设备中的芯片,它们的设计归根结底也都是为满足人类需求而实现的,人类的目的就是它们功能的根本来源。但是对于像人类大脑这样繁琐的生理结构如何带来自主意识这样的功能,哪怕是目前最先进的人工智能系统都无法将其完全解析。所以著名计算学家Emerson Pugh提出了那个有趣悖论,“如果人类的大脑简单到让我们很容易理解它,那么我们人类也会简单到没能力理解大脑”。所以面对各种复杂多样的生理功能能否在自然演化过程中产生,演化论者和设计论者在过去一百多年里从未停止激烈辩论。
作为演化论者,我们必须对此给出充分有力的正面回答,而不仅是在对方挑错中不断缝缝补补。人类设计产品的目的往往五花八门,但对于生物演化的目的,达尔文简单明了地指出,繁殖是其永恒不变的唯一主题。在同一种群中,持有某些表型的个体会呈现出生存与繁殖上的优势,它们的后代在种群中的占比不断提升直到该表型基本被固定下来,新达尔文主义将这种对提升适应度做出的贡献定义为某种表型的功能。例如,许多北极哺乳动物普遍呈现为白色外表,例如北极熊、北极狐、北极狼和北极兔等,这样的表型显然与它们在其他地区的近亲完全不同,白色比其他颜色的外观显然更容易使它们不在冰天雪地的环境中被天敌或猎物发现。又比如,工业革命期间,英国曼彻斯特工厂的黑烟将城市里的树皮与建筑熏黑,于是栖息在其表面的黑色尺蠖蛾比相应的白蛾更容易与融于环境而不被天敌发现,人们在此期间观察到黑蛾子在种群中占比不断提升。这些案例都向我们表明,对环境的适应是我们看到的许多表型被固定下来的原因,一旦环境有变化,适应性优势也随之不断变化。因此选择主义者将生物性状的功能定义为其为生物体生存繁殖带来的适应性优势。

图1、相比于全球各地的近亲,北极地区的哺乳动物普遍有白色的外表,这样更容易融于冰天雪地的环境,降低被天敌或猎物过早发现的风险。
结构主义:非适应性的演化思想
在过去的20世纪,曾一度流行的观点是:所有形态特征都是对某种功能性需求的适应。这些将功能归因于适应的演化思想被称为功能主义(Functionalism),与之相对的另一派演化学者强调从内部结构出发理解性状功能起源,他们将自己的理论称为结构主义(Structuralism)。二者的核心争论在于到底是外因还是内因决定了演化的方向。结构主义强调,许多关键性状的产生并不是因为它更适应环境而淘汰掉其他表型,而是因为别无选择地继承。例如,脊椎动物、昆虫、环节动物、软体动物等普遍采用大脑等唯一中枢神经系统并不是因为“长一个头”比“长两个头”更能适应环境,而是因为继承自祖先的身体架构只允许它们可遗传地长出一个头。
斯蒂芬·杰·古尔德(Stephen Jay Gould),作为一位富有影响力的演化生物学家和史学家,对传统的自然选择理论提出了深刻的批判和补充。他最著名的批判之一,就是针对选择主义—the idea that natural selection is the only or primary mechanism driving evolution(自然选择是演化的唯一或主要驱动力)的观点。古尔德认为生物功能和演化远比这种观点所揭示的复杂得多。在常规理解中,我们将生物的"功能"视为其各种特征或行为的目的,这些特征或行为通过自然选择过程被优化以增加生存与繁殖的几率。例如,羚羊的快速奔跑能力是其逃离掠食者的功能。然而,古尔德指出,自然选择并不总是功能创造者。
以下引用古尔德的原话(翻译)。
选择主义者们往往先把整体拆分成一个个独立的特征,再分别对不同特征做一个适应性的解释。直到撞墙的时候才承认“次优解”存在,退回到整体角度考虑演化,例如喉返神经。虽然他们不得不承认一些非适应性机制对演化的影响,但把它们放在十分次要的位置上(例如把飘变(drift)视为只有有效种群很小的时候才影响演化的因素)。手里只有个锤子,所以看啥都像钉子,见到任何自然界生物的表型都强行编排一个适应性的故事,以证明一切演化过程都是适应性的。(参见《The spandrels of San Marco》p.151 ~ p.153)
为此古尔德打了个形象的比方,这就像San Macro教堂在它方形的墙体和半圆形门洞之间留出的拱肩结构中设计了充满艺术感的壁画,但这些拱肩结构一开始并非为了艺术性而有意建造。演化也是如此,许多性状是其他特征演化的副产品,而不是适应选择的直接产物,古尔德将这种副产物就叫做“拱肩”(spandrel)[1]。他强调必须优先从整体出发,从各性状之间的关联的角度谈性状的起源与演化,而不应该把适应性解释当成第一选择,碰了南墙再回头。在他看来,如果自然选择可以打破任何特征之间的内在相关性,并使各部分分别优化,那么有机体的整合就变得无足轻重了。而事实上,复杂性状的演化密切地受到其历史和结构的影响。对于更普遍的形态演化过程,结构性解释比适应性解释更加合理。

图2、圣马可大教堂的建造者选择在其拱肩区域(spandrel)进行艺术创作(图源:《The spandrels of San Marco》)。
生物体是完整的实体,而不是离散物体的集合。如果我们认为下巴颏是一个单独的“东西”,而不是两个生长领域(牙槽嵴和下颌体)相互作用的产物(图3),那么我们就会对它的起源(重演)做出一种解释,即下巴颏是在适应咬合力的机械运动中产生的[1]。然而利用了一系列先进的生物力学手段,爱荷华大学的研究队伍分析了近40名志愿者的头面部特征,但他们没有发现任何证据表明下巴与机械功能有关[2]。其他可能的解释来自于人类演化过程中激素水平的变化,主要是睾酮激素水平的下降,这有利于提高个体的宽容度而加强合作,是旧石器时代中后期实现更复杂社会分工组织形式所必需的,而这附带的产物就是导致人类颅面部产生显著变化[3]。其中较大的一个变化是面部整体因发育变慢而缩小,下颌骨自然也就相对外凸形成了下巴颏,这涉及到发育的异时性(heterochrony)。
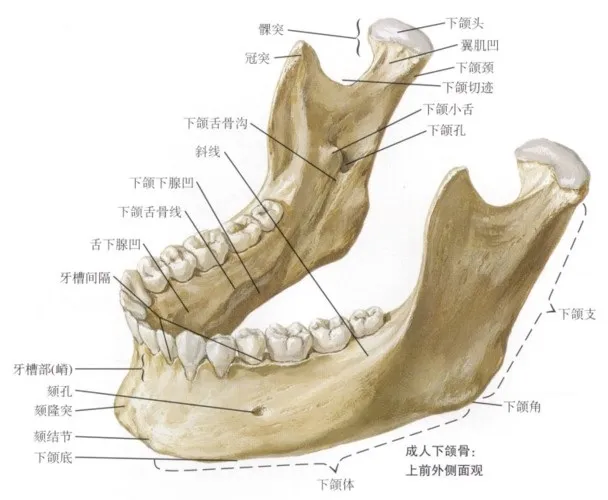
图3、下巴是在牙槽嵴和下颌体相互作用中出现的
“异时性”这一概念揭示了适应性之外的另一个复杂层面。它指的是演化过程中生物的不同组织器官发育速度与祖先的对应器官不成比例而导致的形态变化。例如,在某类动物巨型化的过程中,它的身体发育相比于祖先加快了三倍,但头部只比祖先快了一倍,进而导致头部相比于整个身体的比例变小。马门溪龙等大型蜥脚类恐龙的相对较小的头部就是异时性的典型案例,它们有着夸张的体型和超长的脖子,而且体型变大的过程中头部占比越来越小。这不是因为头部比例越小越好,而是它们内部的不同器官对于激素等发育信号的响应强度存在系统性差异,从而在躯体巨型化过程中无法让每个器官都在小型恐龙祖先基础上实现“齐头并进地等比例放大”。当我们考虑一个复杂的演化过程的时候,并不是所有表型都是由适应性直接决定的,相当多是受到了彼此制约的结构性因素影响。其中某些适应性表型的出现可能让许多特征随之变化,就像前文提到的适应群体合作带来的雄激素下降,额外带来了面部特征改变的效果。
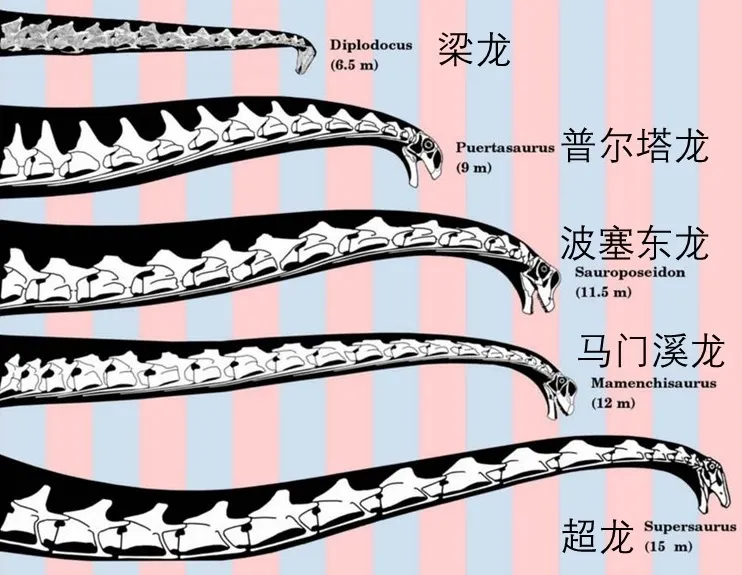
图4、大型蜥脚类恐龙拥有超长的脖子以及与整个体型比起来相对较小的头部。
这与古尔德的另一个著名理论——间断平衡说(punctuated equilibrium)相呼应,该理论认为物种的演化不总是缓慢而渐进的,而是长时间的停滞被短暂而快速的变化事件所打断。发育异时性所强调的,胚胎发育过程中的微小变异可以直接带来巨大的表型变化,是宏观形态演化中普遍存在不连续性的有效解释。
结合了适应性和结构性规律的综合影响,著名古生物学家Adolf Seilacher提出了系统性的形态构造理论(Arbeitskonzept zur Konstruktionsmorphologie)。该理论指出,除了适应性原理之外,还应该考虑两类约束对生物演化带来的普遍影响(图5)[4]。其中,普适约束(formal constrain)泛指地球生物必须遵循的各种普适性规律对其演化轨迹的约束,其既包括一切底层的物理化学原理,也包含中心法则、翻译密码子等更高层次的普适分子机制。例如,飞鱼在跃出水面后由于受到重力又能落回水下继续游动,它们的下落只是利用了普遍存在的重力规律保证自身能回到水中,而不是某种特殊的适应性让它们获得了下坠的功能。我们必须要注意到生物性状的演化必须时刻被这些基础规律严格支配,且无法演化出与之相悖的结构及功能,就像传说中的神仙可以无视空气动力学规律原地起飞。
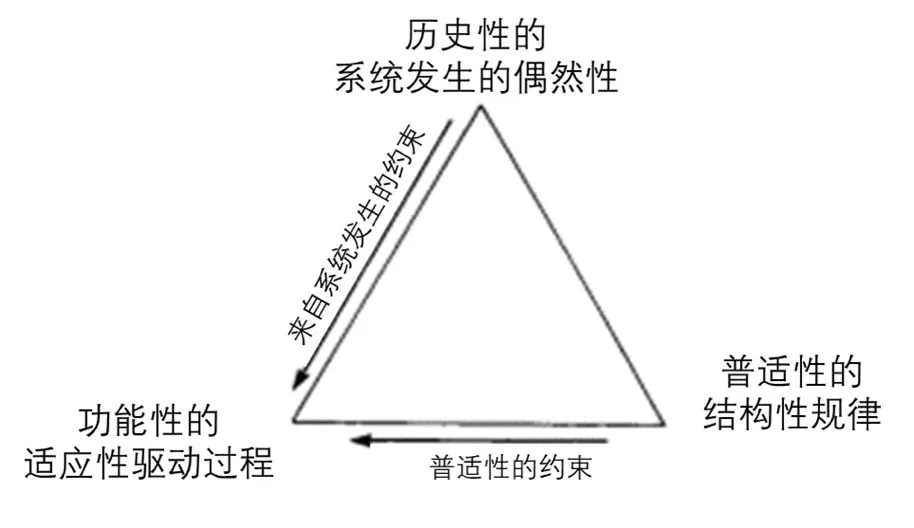
图5、生物特性来源的三大世界观的缩影
相较于那些在生命始祖(Last Universal Common Ancestor,LUCA)出现之前就具备的普适性规律,另一类约束是在特定生物类群在各自的早期演化阶段产生,并对后续演化过程带来重大影响,这被称为历史约束(historical constrain)。例如,哺乳动物的胎生哺乳特征,昆虫拥有头、胸、腹三段分节特征,被子植物有果皮包被的种子,等等。也就是说,不同生物具有高度类似的生理结构和功能,例如组织、器官、细胞类型等,往往并不是这些生物各自独立演化的结果,而是继承了由类群共同祖先建立的保守特征。历史约束是发生在祖先节点处的偶然性演化事件所带来的特殊后果,它往往在后代接下来的演化中扮演重要功能,但不是理论上实现此功能的适应性最优解或唯一解。例如,从大脑穿过心脏动脉返回腮部的喉返神经最早在原始鱼类身上出现,做为控制腮部肌肉的一条脑神经。陆生脊椎动物继承了这一祖先特征的同时又演化出细长的颈部,例如长颈鹿的喉返神经仍需要顺着颈部绕过主动脉再返回喉部才能将吞咽的控制信号传达过去。它们没有从大脑出发“抄近路”控制喉咙不是因为长颈鹿的现状比这种表型更有优势,而是因为它们没机会演化出这种高效结构。
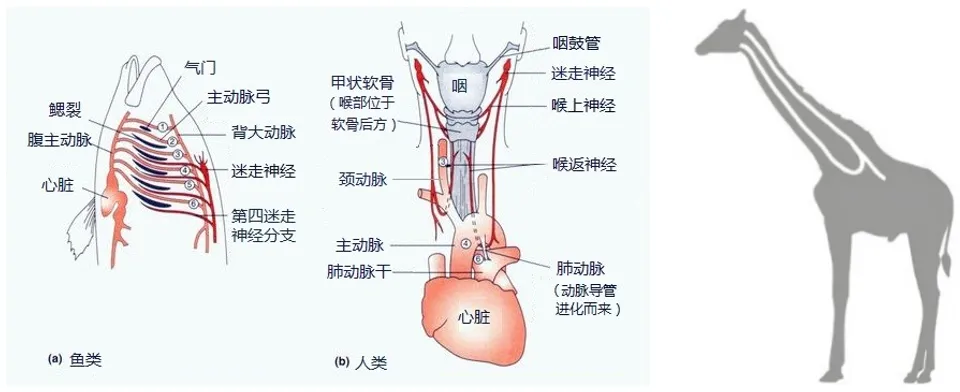
图6、从头部出发绕过主动脉返回颈部的喉返神经,右侧为长颈鹿喉返神经示意图。
如何解释生物性状会受到系统发生关系的强烈约束,而无法演化出相比于祖先“面目全非”的状态?例如,所有脊椎动物都有继承自共同祖先的大脑、脊索、心脏等结构,它们为何在脊椎动物所有分支中都完整地保留了下来,这会带来什么优势?如果它们的维持与某种动物适应海洋、陆地、天空等任何具体外部环境都无关的话,就应该从内部寻找原因。以心脏为例,结构主义给出的解释方案是:心脏是有机体循环系统的动力源,而循环系统保证了各个器官获得必要的养分和氧气。它的功能是由复杂有机体内部不同组织器官之间的相互作用关系决定的,而不是对外部具体环境的适应方式所定义出来的。因此我们将会看到,它们的演化起源需要在非适应性的体系下才能解释清楚。
新性状起源的另一种解释方案
如果我们相信演化论的核心假设,也就是复杂的多细胞动物是从单细胞状态的简单祖先演化出来的,那么动物的组织、器官、神经系统等各种复杂生理结构又是如何从无到有地产生的?达尔文本人就已经意识到这一问题的重要性,如果不能解释新性状的起源问题,演化论就只能去研究建立在已有性状基础上的微小变异,这会让理论的可解释性大打折扣。因此,达尔文提出一种有关预适应的解释方案。例如,鸟类实现飞行需要有一系列基本条件,包括翅膀上细长的飞羽,发达的肌肉,中空的骨骼等一系列复杂条件,只有当它们结合在一起时,鸟类才能获得飞行的能力。因此,当仅有羽毛演化出来的时候,此时的鸟类祖先是不能飞翔的,它首先是用来干别的事情的,这就是预适应(preadaptation)。曾经的主流观点是,鸟类的羽毛最初是因为能起到保暖的功能而被保留下来的,后来在适应飞行的过程中转变为有利于飞行的功能。

图7、鸟类羽毛结构与功能的多样性
这样的解释方案有一个前提,即任何形态演化过程都是连续渐变的,所谓新性状的起源只是旧结构在适应新环境过程中产生了新功能。然而,演化发育生物学(evolutionary developmental biology,evo-devo)则提出截然不同的观点,即新性状就是一种前所未有的结构实体,无论在祖先还是外群都找不到它们的同源结构,它诞生于某种胚胎发育机制的创新,是不连续的演化过程。预适应方案的确能解释一些性状连续过渡的现象,但解释不了全新的结构性特征的起源问题。
面对双方的争论,如果我们想弄清什么是相对的“新”和“旧”,就需要先对表型的同源性下定义,类似于根据基因序列相似性定义出基因同源性。因为只有确认了特征的同源性,跨物种比较才是有意义的,例如要研究人类眼睛的起源,必然要在黑猩猩的所有器官中找到眼睛这个结构与人的做对比。基于生理学与解剖学,我们有充分理由确信不同脊椎动物的大脑、脊椎、心脏等器官都是继承自共同祖先而非独立起源,可一旦涉及跨门类的比较我们就很难直接确认同源性。例如,不同生物的眼睛在生理结构和工作机理上天差地别,其中包括节肢动物的复眼、鹦鹉螺的单孔眼与脊椎动物的眼睛等。然而,任何复杂器官都是从原肠胚阶段的某种特定细胞类型(器官原基)中分化发育而来,因此我们可以根据不同动物的眼睛在各自早期发育阶段是否由类似的发育调控程序激活来判断其同源性。根据这套标准,我们可以确认,脊椎动物和果蝇的眼睛、心脏、体轴、胚层、神经与肌肉系统的基础发育能力都至少可以追溯到两侧对称动物共同祖先以前[5]。也有许多组织器官或次级生理结构则是某个门类特有的,无法追溯到更早的祖先阶段,例如脊椎动物的脊椎、四肢、骨骼和以及更多复杂的脑区结构等。
对于组织器官等复杂性状的起源与复杂化过程,evo-devo认为这不是由适应性优势所驱使的,而是一个不断继承旧结构,并在此次基础上添加发育出新结构能力的过程。Evo-devo的奠基人Rupert Riedl指出,某些相对上游的发育特征,例如胚层、脊索、神经板等结构,其一旦出现,就会为发育出更丰富的下游特征提供条件,它们为形态演化的多样性带来了演化潜力(evolvability);而多种下游特征的累积又提高了上游特征的负担(burden),使其变得高度保守,这是由发育的因果逻辑带来的形态演化规律[6]。例如,脊椎动物的脊椎发育能力由脊索诱导形成,这表明脊椎动物演化自原始的脊索动物;成骨发育能力来自软骨的诱导,因此硬骨鱼的祖先是某种原始的软骨鱼。由此可见,胚胎发育的因果逻辑忠实地反映了重大演化事件的发生顺序。
回到羽毛起源的问题,我们首先应该注意到鸟类体内的羽毛多样性:宽大坚硬的正羽,蓬松柔软的绒羽,以及细长的纤羽等。整齐排布在鸟类翅膀上的飞羽和尾部的尾羽都属于正羽,它们是飞行时提供升力的关键,内部有紧密连锁的小钩与倒刺来保证结构强度,这与保暖的蓬松绒羽在结构上完全不同,我们比较一下羽毛球上的羽毛和羽绒服里的绒羽就能直观感受到(图7)[7]。鸟类身上用来飞行的正羽并不是由保暖的绒羽在适应飞行过程中一对一转化过来的,它们就是两种独立的结构实体,是在一到多的分化过程中起源的。从发育过程来看,鸟类的翅膀、尾巴、腿部、爪子等不同区域的皮下真皮层间充质细胞能不断分泌不同的信号分子,诱导相邻的表皮细胞表达不同成分的角蛋白,组织成不同结构的羽毛或角质层。即便从鸡胚中取出同一块正在发育的表皮,将它与不同区域的真皮组织结合,就会被不同的间充质细胞诱导成对应区域的羽毛或角质层皮肤(图8)。这种细胞分化能力的建立使得鸟类前所未有地获得了多种多样的皮肤成分与羽毛结构[8],因此正羽不是由绒羽演变而来的,而且羽毛整体也不是由爬行类祖先的角质化鳞片的演变产物,它们互不同源。
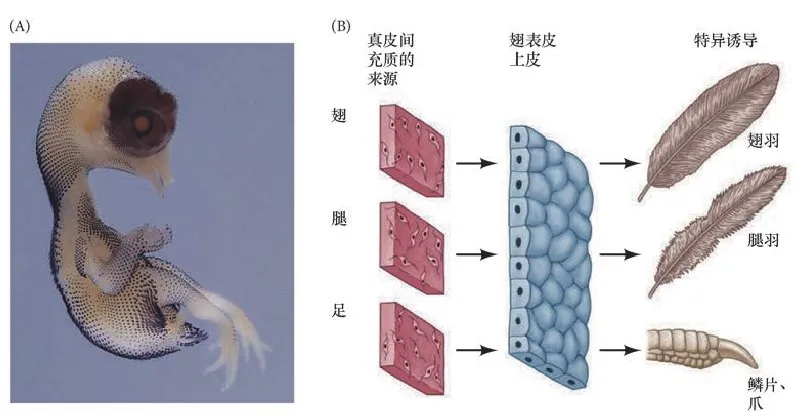
图8、鸟类皮肤羽毛诱导实验。鸡胚不同区域真皮层能诱导出不同的表皮组织(图源:《发育生物学(第11版)》)。
细胞分化机制创新的关键在于细胞诱导。在胚胎发育的绝大多数过程中,每个细胞的分化方向并不是被精准预设好的,而是在与周围其他细胞的相互作用中确定下来的,细胞间的信号通讯和黏附力差异在此起到了决定性作用。有些分泌关键信号分子的细胞能够诱导周围细胞朝特定方向分化,就像前文提到的真皮层间充质细胞。因此,在某个动物类群演化的关键阶段,基因组调控机制的创新可能使得关键的发育调控基因能在新的胚胎区域表达,进而诱导出全新的细胞分化过程,进而产生前所未有的结构实体。
复杂性状的演化
一直以来,演化论被其反对者们最主要批评的角度就是复杂生物系统的组织问题。对于一个人为设计的工业产品,我们可以预先安排好每部分的分工,可自然演化过程又如何能安排好复杂生物系统的关键组成部分的分工协调呢?例如脊椎动物的大脑和眼睛,它们都能被解剖成许多独立的结构,只有当它们组成整体系统的时候,才能共同发挥诸多复杂的生理功能。是什么样的契机让它们开始分工配合,各司其职?如果按照理查德·道金斯在《盲眼钟表匠》里猜测的那样,假如今天人类的眼睛有100个基本零件,则一旦拥有其中的5个零件就会比只有4个零件的阶段更有优势,直到一点点凑齐。但只有必要元件基本组合在一起的时候复杂功能才会出现,就像没有存储器、硬盘与电源,再先进的芯片都无法正常工作,因此只有在完整的电子计算机问世之后芯片才能以摩尔定律的趋势不断提高性能。人类可以为了组成一台完整计算机而先造出其中的芯片,可是晶状体又怎么知道自身该去扮演视网膜的聚光透镜,与之互相配合来实现复杂的视觉成像功能呢?视网膜在晶状体出现之前又如何提前预知:为了形成完整的视觉系统,晶状体一定会到来?如果承认形成复杂生理功能所有必要零件是同时出现的,这就跟神创论并无本质区别了。如果我们想回避“晶状体是为了适配视网膜的聚光需求才出现的”这种目的论叙事,就要先单独讲一个有关它们“原本功能”的预适应故事,可又是什么样的特殊契机能让本来参与其他功能的生理结构走向合作呢?如果可以把一种合作关系的产生归结于偶然,可实现人体复杂生理功能需要无数紧密高效的分工配合难道都是这样吗?对于复杂生物系统的功能起源问题如果采用适应性解释,就必须得不断倒果为因,人为地预设无数目的。
好在发育生物学最近几十年的一系列重大进展打破了笼罩在演化论之上的乌云。从发育的结果来看,视网膜和晶状体是两个在结构和功能上独立的模块,但在胚胎期,二者本就是在密切互作中发育出来的。视网膜的前体,视泡能够诱导头部外胚层区域朝晶状体方向分化,而晶状体反过来也能通过分泌特定信号来诱导视泡变成视杯,并且让视杯分化成两层结构:色素视网膜和神经视网膜(图9,详细内容参见《发育生物学(第11版)》[9])。这种称为互相诱导的关系在胚胎发育过程中十分常见,而且一个结构不需要完全分化才能行使诱导功能,它们能在发育过程中不断诱导对方分化出更复杂的结构。所以眼睛复杂的内部结构不是在演化过程中一次性形成的,而是在确立最基本的互相诱导关系基础上一步步添加上去的。只是在一些关键祖先阶段,二者作为整体被固定为“透镜与屏幕”的基本分工方式。互相诱导的规律使得许多相关组织在初始演化阶段就像签订了契约一样密切关联,共同演化,而非在各自独立演化过程中有什么特殊的适应性机制为它们带来功能上的分工合作。对于密切配合的不同特征,我们必须要从功能背后的内在关联出发寻找整体系统的演化起源,而不是基于它们各自的当前效用分别往前倒推,这样才能彻底摆脱倒果为因的逻辑混乱。最典型的例子就是真后生动物的所有组织器官和生理结构都是在原肠胚的三个胚层互相诱导中分化出来的,这一基础发育能力的构建使得前寒武纪动物祖先的生理结构复杂性获得了史无前例的爆发式提高,也就是我们在化石群中见到的寒武纪物种大爆发现象。
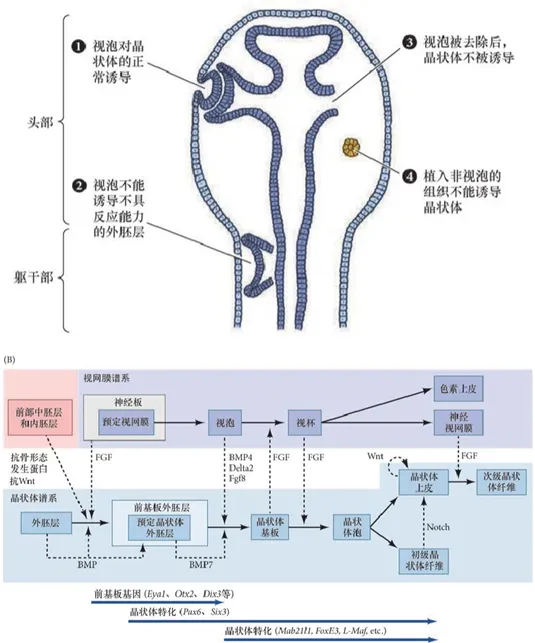
图9、视网膜与晶状体的相互诱导模式(图源:《发育生物学(第11版)》)。
总之,无论是有关功能转化的预适应模式,还是有关新结构起源的演化创新,都表明性状的功能起源与演化都不是以适应其在当下的状态为目的而进行的,而是表现出促进未来更多适应可能性的演化潜力。演化不只有基于适应而将等位基因型与表型多态性逐渐固定下来的收敛性过程,更多的是产生无数适应轨迹的发散性过程。上游细胞分化机制的建立会提供前所未有的下游表型多态性空间,开辟出更高维的适应性景观,带来辐射演化的可能性,例如肢芽发育能力的构建为脊椎动物四肢多样性的贡献。因此,古尔德为了概括对这些性状在功能的起源与转变过程的演化意义,决定弃用“预适应”这一暗含目的论的概念,而将其囊括进一个更加广泛的概念之中,即拓展适应(exaptation):涉及复杂性状的演化并不应该看成一条固有的适应性轨迹,而应该去思考更广泛的适应性空间是如何形成的。
传统的演化生物学研究主要是在种群内或跨物种间进行比较,研究同源特征的差异,这类研究可以被概括为“你的眼睛为什么跟他的眼睛不一样”。而发育生物学研究的是细胞分化如何形成个体内部组织器官的异质性,即“你的眼睛为什么跟你的鼻子不一样”。以恩斯特·迈尔为代表的主流演化学界曾一度认为,因为繁殖的基本单元是个体,个体内部的异质性只是遗传信息的表达结果,所以发育问题对于演化研究毫无意义。但随着evo-devo理论的发展,正如前文所示,除了横向的跨个体跨物种比较之外,研究复杂性状的起源与演化还需要纵向地分析个体内的细胞分化方式。这是因为不同性状往往不是彼此完全独立地演化,而是有着千丝万缕的内在关联,这导致复杂生物不能“随心所欲”地长成任意形态。除了适应性带来的影响之外,分析那些性状产生所遵循的内在规律与因果逻辑对于演化生物学研究同样重要。
参考文献
[1] GOULD S J, LEWONTIN R C. The spandrels of San Marco and the Panglossian paradigm: a critique of the adaptationist programme [J]. Proc R Soc Lond B Biol Sci, 1979, 205(1161): 581-98.
[2] HOLTON N E, BONNER L L, SCOTT J E, et al. The ontogeny of the chin: an analysis of allometric and biomechanical scaling [J]. J Anat, 2015, 226(6): 549-59.
[3] CIERI R L, CHURCHILL S E, FRANCISCUS R G, et al. Craniofacial Feminization, Social Tolerance, and the Origins of Behavioral Modernity [J]. Current Anthropology, 2014, 55(4): 419-43.
[4] GOULD S J. A DEVELOPMENTAL CONSTRAINT IN CERION, WITH COMMENTS ON THE DEFINITION AND INTERPRETATION OF CONSTRAINT IN EVOLUTION [J]. Evolution, 1989, 43(3): 516-39.
[5] CARROLL S B. Endless Forms Most Beautiful: The New Science of Evo Devo [M]. W. W. Norton, 2006.
[6] WAGNER G P, LAUBICHLER M D. Rupert Riedl and the re-synthesis of evolutionary and developmental biology: body plans and evolvability [J]. J Exp Zool B Mol Dev Evol, 2004, 302(1): 92-102.
[7] BENTON M J, DHOUAILLY D, JIANG B, et al. The Early Origin of Feathers [J]. Trends Ecol Evol, 2019, 34(9): 856-69.
[8] CHANG W L, WU H, CHIU Y K, et al. The Making of a Flight Feather: Bio-architectural Principles and Adaptation [J]. Cell, 2019, 179(6): 1409-23.e17.
[9] GILBERT S F, BARRESI M J F. Developmental Biology [M]. Oxford University Press, 2018.










