探秘“两脚兽”:人类并不孤单
“真是一只奇怪的两脚兽啊!”慵懒的午后,四只爪子的小猫咪躺在窗边,望着眼前的人类,发出这样的感慨。
在猫咪的世界里,两只脚走路的生物只有人类。但是作为知识渊博的人类,我们需要认真地纠正小猫咪的错误:“两脚兽”——不止于人。
在广阔的自然界的舞台上,能够用双足(Bipedal)运动的动物不在少数。
我们的灵长类亲戚,例如黑猩猩和大猩猩,可以进行短距离的双足行走;一些蜥蜴,比如 Basilisk lizards,是远近闻名的“水上漂”——它们可以只用后腿在水上飞奔1;南非穿山甲(Smutsia temminckii)的前爪高度适应挖掘,指甲又长又大,导致它们几乎只能用后腿走路2;当然还有一些哺乳动物,例如袋鼠、跳鼠,它们可以用双足跳跃的形式进行快速移动——它们的祖先都是生活在荒漠的小型动物,因此演化出了爆发式的跳跃方式来加速逃跑。
当然,这些动物的运动方式大多都是偶发(Occasional bipeds)或兼性双足行走(Facultative bipeds)的,而现存采用专性双足行走(Obligate bipeds)方式的物种,除了戏称自己是“两脚兽”的人类,就只有前肢已经特化成翅膀的鸟类了(也有人更详细的将人类定义为惯常双足行走(Habitual bipeds),因为在爬陡坡或爬树时,人们还是会自发地使用四肢)。
那么,在丰富多彩的动物王国中,为什么会演化出双足行走的方式?这种行走方式有什么好处?不同物种的双足行走是不是和趋同演化(Convergent)有关呢?

一些可以双足行走的动物。笔者绘,动物参考图源网络。
动起来,以更节能的方式
想象一下,一条金鱼在鱼缸里快活地游泳——在水中,浮力帮助它维持平衡和游泳姿势。在鱼缸旁,一只好奇的小猫正蹲在旁边紧紧地盯着它——对陆生动物而言,当浮力不再抵消重力,如何保持平衡和姿势成为了猫咪“运动装置”(骨骼)的重要附加任务。因此,陆生动物,比如猫,演化出了有关节的四肢来更好地支撑身体并有效移动3。
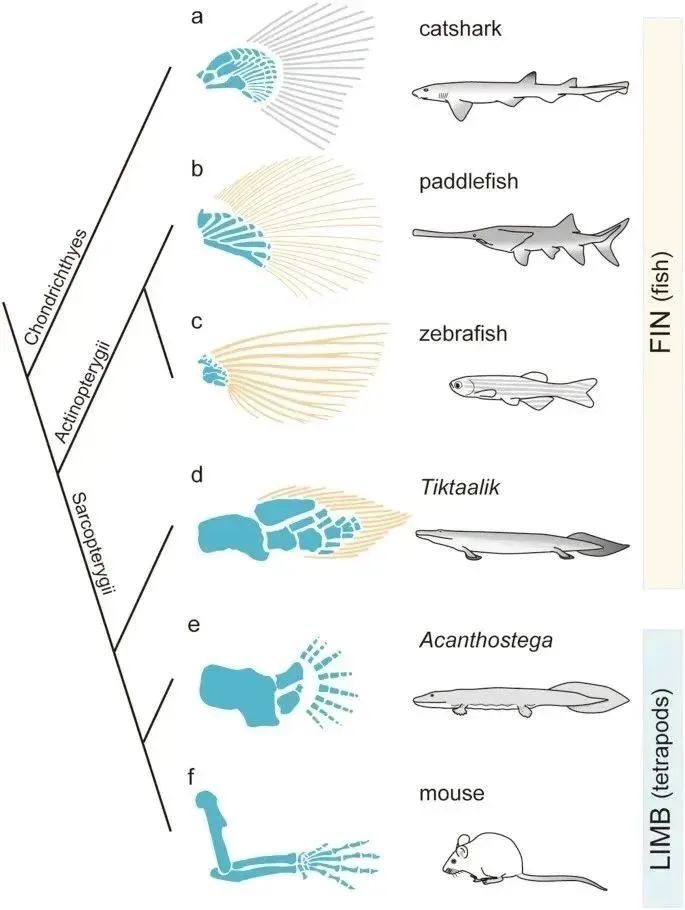
胸鳍与前肢的比较解剖学4。四足动物的四肢在演化上起源于成对的鳍。肉鳍鱼(如Tiktaalik)和茎四足动物(如Acanthostega)的化石为鳍向肢过渡的发育背景提供了线索,为演化发育生物学提供了一个有趣的模型。在鳍到肢体的演化过程中,四足动物的祖先似乎经历了两个主要变化:软骨内区域的扩张(蓝色部分)和鳍条的丧失(黄色部分)。
而和猫咪相比,被称作“两脚兽”的我们,只用一对肢体进行站立和运动并不是一种很“稳当”的方式。尤其是,在现存的四足动物(Tetrapods)中,专性的两足行走只在人类和鸟类中出现,似乎证明了双足行走并不是一个更加普遍适用的生物学形态。然而,鸟类和人类能够“大放异彩”(现存一万多种鸟类,人类在地球生态系统中拥有重要地位),一定程度上就依赖于双足行走这个演化过程中的“关键创新”(Key innovation)。
那么,双足行走这种“关键创新”给我们带来了什么好处呢?直观上看,在行动中只占用了一对肢体,剩下的一对就有机会得以释放,可以用于其他活动,比如使用工具、携带物品或是飞行。这种适应性使得生物能够更好地适应环境和生存需求。
更关键的是,双足行走是更加节能高效的步态。我们的腿就像一个弹簧,可以在行走时存储和释放能量。这种杠杆作用和弹性能量的运用,让我们走得更远、更轻松。我们步行的成本低于我们体型预期的成本,并且比黑猩猩的运动成本低得多(约 75%)5。在这种情况下,降低行走的能量成本就是降低觅食成本,为早期人类提供了相对于其他猿类的演化优势。另外对于陆生鸟类来说,它们的两足行走也非常高效 (鸡的能量回收率高达80%)6。
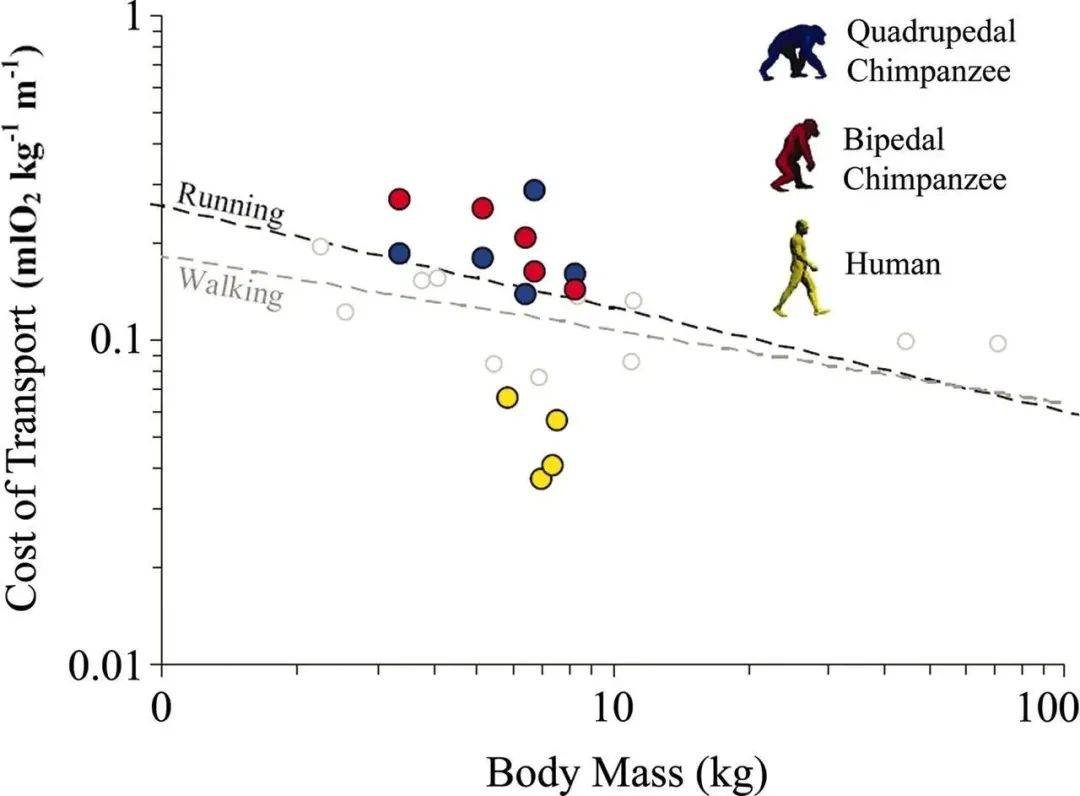
黑猩猩四足行走(蓝色)、黑猩猩双足行走(红色)和人类行走(黄色)的净运输成本5 。虚线表示哺乳动物( 65 种陆地物种)跑步或行走的回归曲线。人类在走路和跑步上的“能耗”和其他陆地物种比很低。
站起来,迈步向前冲
鸟类为什么会双足行走呢?直到20世纪80年代,人们都没有考虑过关于鸟类的这个问题,毕竟解释似乎太明显了——因为鸟类的前肢是翅膀7。然而,随着对鸟类起源于恐龙这一认知的深入,人们才渐渐意识到,鸟类的双足行走特征实际上源自它们的恐龙祖先,即鸟类的双足行走在翅膀演化之前就已经存在。因此,让我们先从恐龙谈起。
目前,所有已知的兽脚亚目(Theropod)的恐龙都是专性双足动物(尽管有人认为北非的埃及棘龙是四足行走的例外8)。而正是这一支恐龙中,演化出了现代鸟类9。实际上,双足行走在某种程度上是所有恐龙种群的基本特征。例如已知的最古老的恐龙(包括鸟臀目(Ornithischians)的始奔龙( Eocursor),以及蜥脚类的(Saurischians) 始盗龙(Eoraptor)等)都是专性两足动物。因此,恐龙的两足行走是单一起源的,反倒是四足行走,是在多个谱系中独立演化的。

恐龙谱系中不同的行走方式。绿色的是专性双足行走的恐龙,蓝色的是兼性双足行走的恐龙,紫色的是四足行走的恐龙10。恐龙在祖先时期就采取了双足行走的方式。
为什么恐龙的祖先会采取双足行走的方式呢?
关于恐龙祖先采取双足行走的原因,目前还存在不少猜测。无论是哪种选择压力导致了恐龙的双足行走,它们的祖先可能经历了一个由专性四足行走逐渐转变为专性双足行走的过程。因此,为了更好的了解恐龙行走方式的的演化阶段过渡,我们需要在现代生物中寻找兼性双足行走的例子,以便进行类比,推测其适应功能学的起源。
那么,让我们来看看有鳞目 ——一些蜥蜴通常在需要以最大速度奔跑时,例如逃离危险时,会采用双足行走的方式,而大部分情况下,它们主要还是四足行走的。这种行为在飞蜥科(Agamidae)、冠蜥科(Corytophanidae)、鬣蜥科(Iguanidae)等几个蜥蜴类群体中特别普遍,并且是独立地多次演化而来的11。

© Giphy
因此,在蜥蜴的世界里,双足行走和高速奔跑能力之间存在着一种有趣的联系11。蜥蜴突然地加速会让它的重心移到臀部,因此双足的运动方式似乎是这种高速冲刺“被逼无奈”而带来的结果(就像一些特技摩托车手,在加速的过程中变化重心使前轮腾空,只用后轮进行驱动)。不过,这种双足的高速奔跑似乎与我们的直觉相悖:对于蜥蜴来说,为什么减少了一组肢体的使用,奔跑的性能反而提高了呢?
这就不得不提双足行走的蜥蜴演化出的非常强大的尾股肌系了。和它的前肢肌肉群相比,蜥蜴后肢提供主要动力的肌肉体积远超前肢的肌肉12。此外,由于尾股肌肉独特地沿着尾巴排列,它们可以在后方延伸和横向增大,几乎不受限制。因此,那些会高速双足奔跑的蜥蜴,通常具有异常长且大的尾股肌肉。
让我们把目光再转回到恐龙。和蜥蜴一样,恐龙也有着非常强大的尾骨肌系。许多标志着早期恐龙的解剖特征,包括一些通常被视为共同衍生的特征,都与增强的尾股肌肉复合体有关。这些特征包括尾椎上突起的尾肋12,它有助于扩大尾股肌肉的体积,以及股骨第四转子的突出和不对称形态。也就是说,尾股肌系对于恐龙来说,也是它们后肢的主要动力来源。
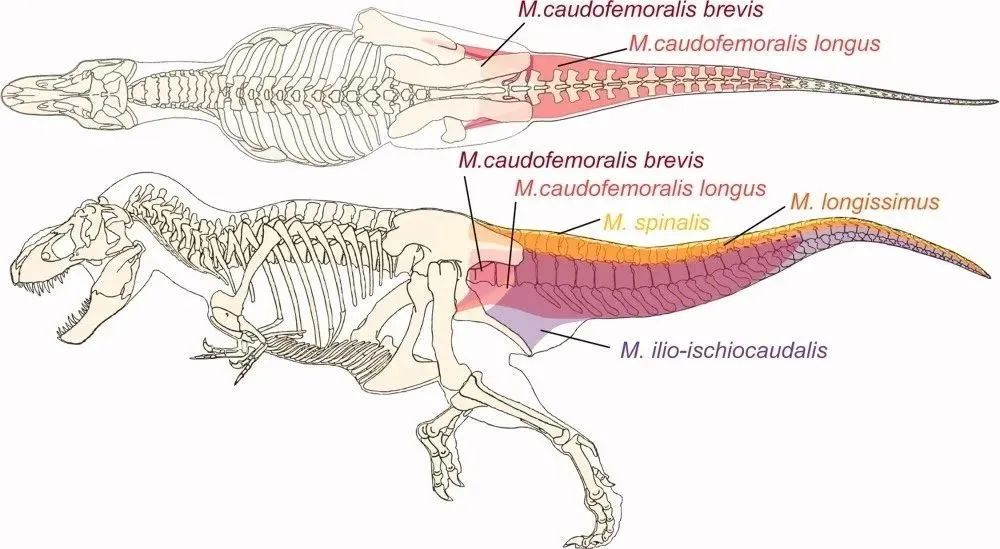
霸王龙(Tyrannosaurus)的尾骨肌系(M.caudofemoralis)示意图12 。其尾骨肌系和尾部肌肉结构对其双足行走能力起着至关重要的作用。
因此我们不难猜测,早期的恐龙体型比较小,周围有许多大型的捕食者,比如各种镶嵌踝类主龙(Crurotarsans)(也就是向现生鳄类方向演化的主龙类)13。在这种环境下,速度和灵活性对于逃避捕食者和追捕小猎物至关重要。
和蜥蜴类似,这些早期恐龙的祖先拥有强壮的尾部肌肉,帮助它们在必要时能够快速奔跑。与蜥蜴不同的是,恐龙的祖先可能会更加活跃,能持续更长时间的高速奔跑。为了适应这种长时间的奔跑,它们的后腿和与之相连的骨盆和尾巴结构逐渐变得更加适合双足站立。同时,由于前肢用于行走的频率减少,它们变得更短更轻,这有助于恐龙更好地在后腿上保持平衡。
最终,这些恐龙完全适应了用两条后腿来支撑身体,并进行各种速度的运动。它们的前肢逐渐退化,不再用于行走。这样,它们就形成了一种完全依赖于双足行走的高效恐龙形态,提高了它们的奔跑能力,成为了那个时期的地球“霸主”。
人与鸟,殊途同归?
之前我们提到,人类和鸟类是现存“唯二”的专性双足行走的动物,那么我们人类和鸟的后肢会有什么明显区别吗?
让我们先说回现代鸟类。
鸟类的双足行走源自它们的恐龙祖先,但是它们的双足行走的方式却有着很大的不同。在恐龙演变为鸟类的过程中,后肢肌肉的支撑和移动身体的能力都经历了巨大的变化。
恐龙到鸟类中最明显的行走方式变化是从“臀部驱动”(Hip-driven)变化到了“膝盖驱动”(Knee-driven)。在这个过程中,鸟类的尾巴长度缩减,臀部和膝盖的肌肉发生了一系列的复杂变化,前肢增大,并演化出了“巨大”的胸肌来增加飞行能力,这些都促使鸟类以更加“蜷曲”的腿部姿势行走。
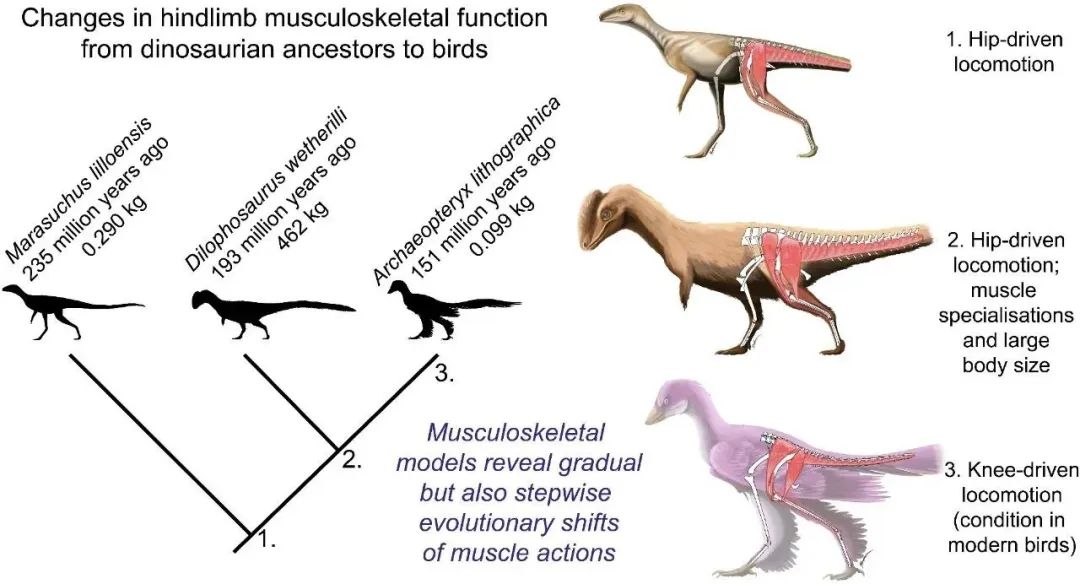
palaeoartist ©Jaime Headden。在2.3亿的时间中,恐龙在陆地上的运动方式从最早的“Hip-driven”过渡到了鸟类的“Knee-driven”。
因此,对于鸟类来说,它们的髋关节总是弯曲的,膝盖也是如此,这些关节配置使躯干和股骨保持倾斜位置;而人类的躯干是垂直的,这有助于平衡HAT (Head + Arms + Trunk)的质量,从而更加稳定。
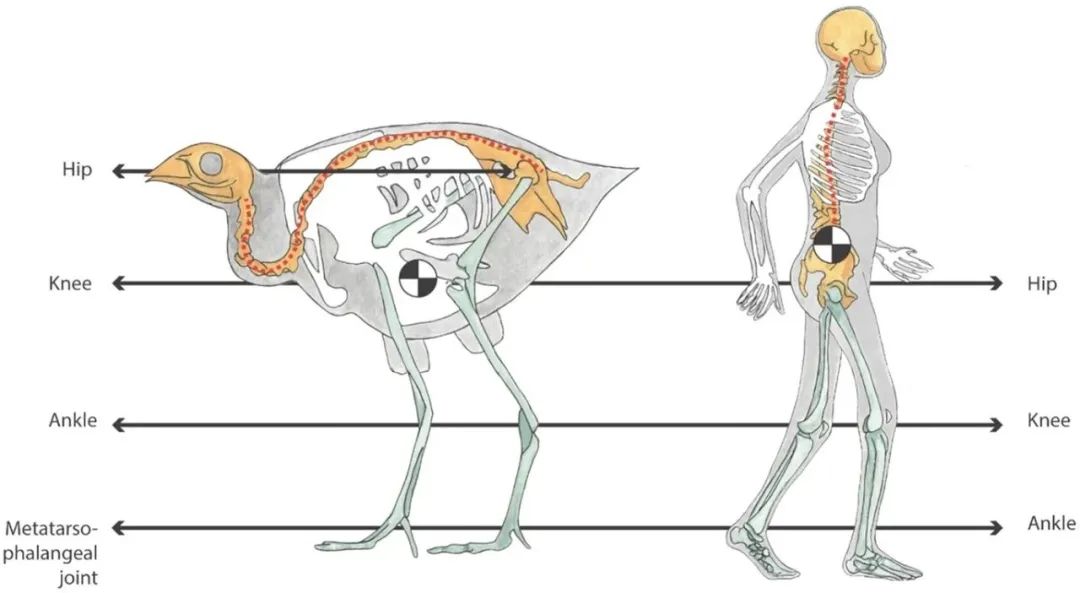
鸟类和人类后肢的结构14。人的脚踝对应鸟类的跖趾关节,人的膝盖对应鸟类的踝关节,人的臀部对应鸟类的膝盖。在鸟类中臀部位于BCoM上方(由黑白填充的圆圈表示)。
鸟类与人类之间的另外一个重要区别在于,鸟类是趾行的(Digitigrade),而人类则是跖行的(Plantigrade)。从解剖学的角度来看,人类的脚踝相当于鸟类的跖趾关节。这种结构差异导致人类的身体质心(BCoM)位于后肢上方,而鸟类的肢体则延伸至BCoM的上方。因此,鸟类的重量主要集中在了臀部以下,而在人类中,超过三分之二(约为68%)的体重位于臀部以上15。

日本插画家Satoshi Kawasaki的作品,显示了如果人类和鸟类是同样的骨骼结构,那我们会长成什么样。这个插画家创作了一系列富有想象力的作品,以人类和其他物种做对比,来展示不同物种骨骼的不同结构。
虽然人类和鸟类的腿在解剖学上有很多不同之处,但是它们的行走方式都是双足的,那么,鸟类和人类的双足行走是否展现出趋同(Convergent)的解剖特征呢?
要讨论这个问题,以及这些特征是否适应于相似环境时,答案并非是直截了当的。因为不同的鸟可以适应各种生态位:树栖、空中、水生和陆地;而人类显然更适应于陆地环境。如果我们仔细考虑树栖和陆地运动的适应性,发现灵长类和鸟类的后肢一直处于巨大的选择压力下。
如果我们先考虑树栖的情况——具有良好握抓性的后肢可以被视为是灵长类和鸟类对树栖生活适应的一种趋同特征16:在鸟类中,拇趾在树栖种类中相对较大,而在陆地种类中相对较小;在栖息在细小的树枝上的灵长类中,拇趾相对较大,而在地面行走或在较大的树枝上行走的灵长类中则较小17。在陆地环境的情况下,人类的拇趾失去了对立性,所有脚趾都朝向前方;在陆地鸟类中,拇趾相对于树栖鸟类而言较小,一些只在陆地活动的鸟类比如鸸鹋(Emu),甚至完全失去了对向的拇指;而在鸵鸟(Ostrich)中,不仅拇趾消失,第二趾也消失了,仅剩下两个巨大的、适合陆地奔跑的脚趾。
因此,人类和鸟类行走的趋同性不太可能直接与双足行走本身相关,而更可能的答案是,后肢的前端(Autopodium)部分与外界环境的接触(树枝/地面)展现了一些功能性的相似之处。
对于鸟类和人类来说,双足行走的方式在一定程度上解放了肢体的发育限制(Developmental constraints),促使人和鸟的前肢和后肢发生不同的功能分化。在人类的演化历程中,双足行走使得前肢从原本的支撑和行走功能中解放出来,进而演化成了更灵活和专业化的工具;对于鸟类而言,双足行走为前肢演化成了翅膀提供了可能,使得鸟类能够在空中移动和觅食,从而开拓了全新的生态位。
然而,这些发育限制又是如何反应在前后肢发育的不同分子机制层面上,至今鲜少有人研究。在笔者最近的一项工作中,我们发现,鸟类的肢体/手指基因表达水平上的演化速率显著高于一些四足行走的动物,并且在胚胎发育时期,从肢芽(Limb bud)到个体手指(Digit)发育的晚期,鸟类前后肢的差异表达基因在逐渐增加,并显著高于四足行走的爬行类。这些结果在基因表达的层面支持了在鸟类演化和发育过程中,前肢和后肢之间功能差异增加,发育限制减少。随着进一步的研究,我们将能更加深入地探索双足行走这一演化创新,并理解这些多样性是如何在遗传和发育层面上得以体现和发挥作用。
参考文献
1. Glasheen, J. W. & McMahon, T. A. A hydrodynamic model of locomotion in the Basilisk Lizard. Nature 380, 340–342 (1996).
2. A review of the anthropogenic threats faced by Temminck’s ground pangolin, Smutsia temminckii, in southern Africa.
3. Shubin, N., Tabin, C. & Carroll, S. Fossils, genes and the evolution of animal limbs. Nature 388, 639–648 (1997).
4. Tanaka, Y., Kudoh, H., Abe, G., Yonei-Tamura, S. & Tamura, K. Evo-Devo of the Fin-to-Limb Transition. in Evolutionary Developmental Biology: A Reference Guide (eds. Nuño de la Rosa, L. & Müller, G. B.) 907–920 (Springer International Publishing, 2021).
5. Sockol, M. D., Raichlen, D. A. & Pontzer, H. Chimpanzee locomotor energetics and the origin of human bipedalism. Proc. Natl. Acad. Sci. U. S. A. 104, 12265–12269 (2007).
6. Muir, G. D., Gosline, J. M. & Steeves, J. D. Ontogeny of bipedal locomotion: walking and running in the chick. J. Physiol. 493 ( Pt 2), 589–601 (1996).
7. Du Brul, E. L. The General Phenomenon of Bipedalism. Am. Zool. 2, 205–208 (1962).
8. Ibrahim, N. et al. Semiaquatic adaptations in a giant predatory dinosaur. Science 345, 1613–1616 (2014).
9. Brusatte, S. L., O’Connor, J. K. & Jarvis, E. D. The Origin and Diversification of Birds. Curr. Biol. 25, R888–98 (2015).
10. Persons, W. S. & Currie, P. J. The functional origin of dinosaur bipedalism: Cumulative evidence from bipedally inclined reptiles and disinclined mammals. J. Theor. Biol. 420, 1–7 (2017).
11. Aerts, P., Van Damme, R., D’Août, K. & Van Hooydonck, B. Bipedalism in lizards: whole-body modelling reveals a possible spandrel. Philos. Trans. R. Soc. Lond. B Biol. Sci. 358, 1525–1533 (2003).
12. Persons, W. S., 4th & Currie, P. J. The tail of Tyrannosaurus: reassessing the size and locomotive importance of the M. caudofemoralis in non-avian theropods. Anat. Rec. 294, 119–131 (2011).
13. Brusatte, S. L., Benton, M. J., Ruta, M. & Lloyd, G. T. The first 50Myr of dinosaur evolution: macroevolutionary pattern and morphological disparity. Biol. Lett. 4, 733–736 (2008).
14. Druelle, F., Abourachid, A., Vasilopoulou-Kampitsi, M. & Aerts, P. Convergence of Bipedal Locomotion: Why Walk or Run on Only Two Legs. in Convergent Evolution: Animal Form and Function (eds. Bels, V. L. & Russell, A. P.) 431–476 (Springer International Publishing, 2023).
15. Palmer, C. E. Studies of the Center of Gravity in the Human Body. Child Dev. 15, 99–180 (1944).
16. Abourachid, A., Fabre, A.-C., Cornette, R. & Höfling, E. Foot shape in arboreal birds: two morphological patterns for the same pincer-like tool. J. Anat. 231, 1–11 (2017).
17. Preuschoft, H., Godinot, M., Beard, C., Nieschalk, U. & Jouffroy, F. K. Biomechanical considerations to explain important morphological characters of primate hands. in Hands of Primates (eds. Preuschoft, H. & Chivers, D. J.) 245–256 (Springer Vienna, 1993).










