猫为什么比你会闻?
“气味”无处不在:阳光暖洋洋的气味,烧烤令人垂涎欲滴的香气,以及榴莲独特的果香等。作为zhoulab铲屎官大军中的一员,我每天醒来的动力可能不是闹钟或者发财发paper的梦想,而是我家那位在床头拉的一泡尿或者猫砂盆里新鲜出炉的便便。猫便便中的挥发性臭味物质主要包括:吲哚、粪臭素、硫化氢、胺/氨类,这些气味分子会刺激鼻腔内的主嗅觉上皮(Main olfactory epitheliums, MOEs)中的嗅觉感受神经元(Olfactory sensory neuron,OSN)产生神经信号,其被传导到大脑中的嗅球经处理后传递给大脑皮层,由此闻到臭味。
事实上,嗅觉对动物的生存至关重要,包括发现食物、寻找配偶/后代、躲避天敌和标识领地等。嗅觉受体(Olfactory Receptor, OR)在嗅觉系统识别气味的过程中发挥关键作用,于哺乳动物中由最大的多基因家族编码。Buck和Axel在1991年因首次发现了负责识别气味分子的嗅觉受体基因荣获了2004年的诺贝尔生理或医学奖。OR基因主要表达在鼻腔中的主嗅觉上皮(MOEs)的嗅觉感受神经元(Olfactory sensory neuron,OSN)中,但也被发现在人和大鼠的一些器官组织中少量表达如心、脑和睾丸等,后者可能与精子的趋化性相关。一般来说每个OSN仅表达上千个OR基因中的一个用以识别一种气味分子,因此我们可以闻到不同的气味。
为什么人类的嗅觉弱于其它哺乳动物如老鼠、猫狗或大象?
如果我们倒溯脊椎动物的演化历史,会发现嗅觉受体在四足动物登陆后发生了显著变化:在大多数水生鱼类中,嗅觉受体主要是I型,能识别水溶性气味分子;陆生动物则主要是II型,只能识别空气中的气味分子,并且陆生动物包括两栖的功能性OR II型基因要显著多于鱼类。在早期的哺乳动物基因组研究中发现,人类的嗅觉基因大约在800个左右,其中超过一半已经失去了功能(假基因),而小鼠有超过1000个功能完好的OR基因,而非洲象拥有目前已知哺乳动物最多的OR基因:2000+(图一;Yoshihito et al., 2014)。
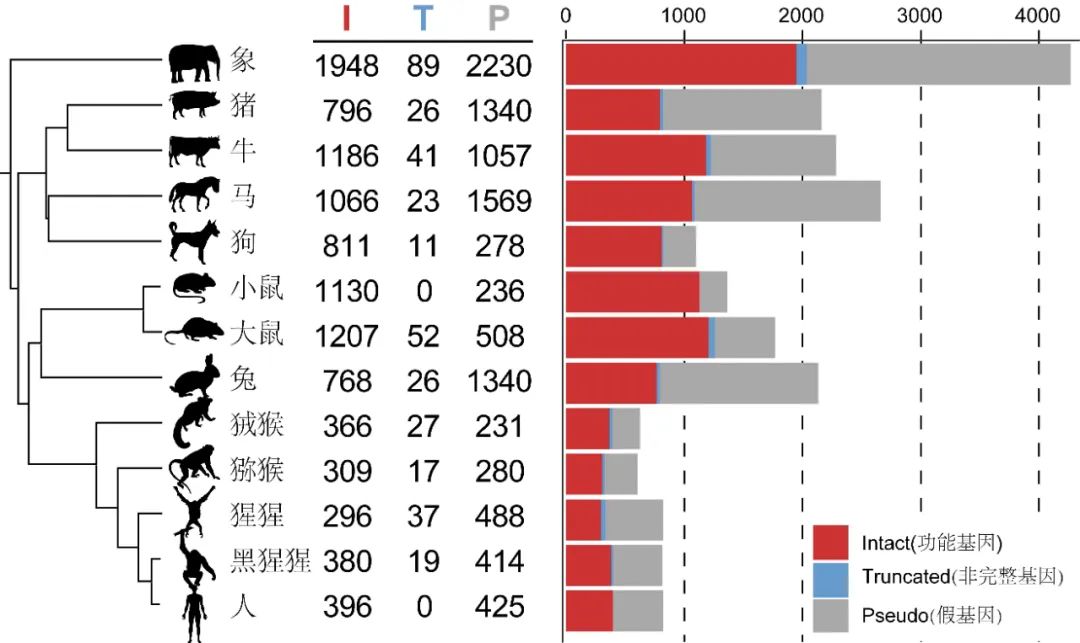
图一 13种有胎盘哺乳动物的嗅觉基因数量(Yoshihito et al., 2014)
研究通过重构嗅觉基因家族的演化推测,哺乳动物的祖先可能有700-800个功能性嗅觉基因,但随后这一数量在不同物种中发生了频繁的收缩和扩张,可能是由于选择性放松和适应性选择的平衡。啮齿类动物主要依赖嗅觉生存,因此OR基因的数量发生了显著扩张;相反,包括人类在内的高级灵长类动物(相比于新世界猴)演化出了完整的三色视觉,使它们不再完全依赖嗅觉来寻找食物或交配,比如通过对红色的识别可以更容易找到成熟的果实,通过充血发红的性器官判断发情的异性或远距离发现天敌等。因此,对嗅觉的依赖降低使得嗅觉基因的受选择压力放松从而导致大量假基因化或基因丢失。类似的现象也出现在鸟类身上,它们由于视觉系统的升级导致嗅觉基因的趋同退化。嗅觉基因退化的证据还常见于由陆生转变为水生后的哺乳动物或爬行动物(如鲸鱼/海豹和一些龟鳖/鳄鱼等)、食性变化的大熊猫、依靠超声波捕食定位的蝙蝠或在寒冷高原适应性生存的牦牛/藏猪等。需要指出的是,嗅觉的广度与灵敏度不能混为一谈:前者是分辨气味的种类而后者是对某种气味的检测限度。例如2014年一篇发表在science杂志上的文章表明人类对很多气味相比以嗅觉著称的小鼠、猪和狗更敏感。
此外,高级灵长类和鸟类等动物退化丢失的不仅仅是嗅觉基因,还包括另一套嗅觉系统—犁鼻器。犁鼻器位于鼻子和口腔的交界处(图二),其内的犁鼻器受体并不感受空气中的气味分子,而是识别信息激素并将信号经大脑中的副嗅球传导到下丘脑。例如,猫科/啮齿类动物可以通过犁鼻器识别同类尿液中的信息素来判断发情/健康状态等,大象也能通过信息素进行交流。实际上在人类的早期胚胎中仍能看到犁鼻器的踪影,但在胚胎发育完全后则几乎完全消失了。这也引申出了一系列有趣的问题:犁鼻器是如何在胚胎发育过程中逐渐退化的?其存在对早期胚胎的发育是否存在积极的意义或仅仅是演化的副产物?
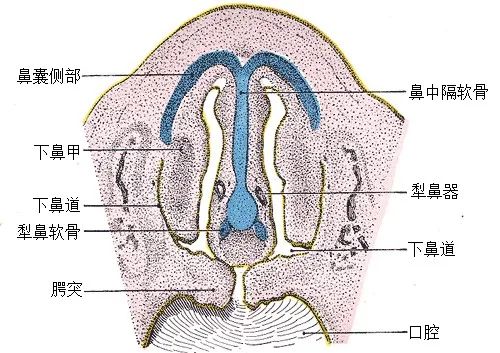
图二 犁鼻器位置标示于28毫米长的人体胚胎;图片来源自wikipedia
独特调控嗅觉基因表达的三维互作模式
在上文中提到,单个OSN神经元只单等位(Monoallelic expression)表达一个OR基因,这种模式的必要性似乎比较容易理解:如果一个神经元能够同时被多种气味刺激,那么动物对气味的分辨率就会下降,导致无法有效分辨成熟果实的气味或分辨天敌等。问题在于,如何保证每个OSN精准单等位表达一个OR基因同时使所有其它OR基因保持沉默?随着三维基因组技术的成熟,我们逐渐有了比较清晰的答案。OR基因在OSN的单等位表达主要依赖两种跨不同染色体位点的空间互作:一是所有来自不同染色体(在小鼠中共18条,人类中有21条)的OR基因形成一个独特的异染色质空间互作中心(Heterochromatic hub),其中所有的OR基因都被常性异染色质组蛋白修饰标记(H3K9me3和H4K20me3)覆盖,从而保证OR基因都处于转录抑制状态;二是来自多条染色体的多个增强子在空间上聚合形成靠近细胞核中心的转录活跃中心(Enhancer hub),激活单个OR基因的表达(图三)。在小鼠中,这类增强子共有63个,被称为“Greek islands”(希腊群岛)。每个OR等位平均会被4-9个增强子调控,因此63个Greek islands间的不同组合理论上足以调控超过2000个OR位点。这两种类型的染色体间相互作用对调控OR基因表达至关重要。近期研究发现,在感染新冠后出现嗅觉失灵的症状,通过解剖分析病毒感染后的人类和仓鼠的嗅觉神经元,发现在神经元未出现明显损伤的情况下,OR基因的空间互作网络发生扰乱可能是嗅觉失灵的直接原因之一(图三)。此外,随着年龄的增长,人的嗅觉逐渐减退:20-50岁之间嗅觉最为灵敏,50岁以后逐渐衰退,80岁以上者有50%再也闻不出任何气味。这种伴随衰老发生的变化在分子层面上,相比于OR基因DNA序列的改变,更可能是其三维互作调控网络出现了退化紊乱。
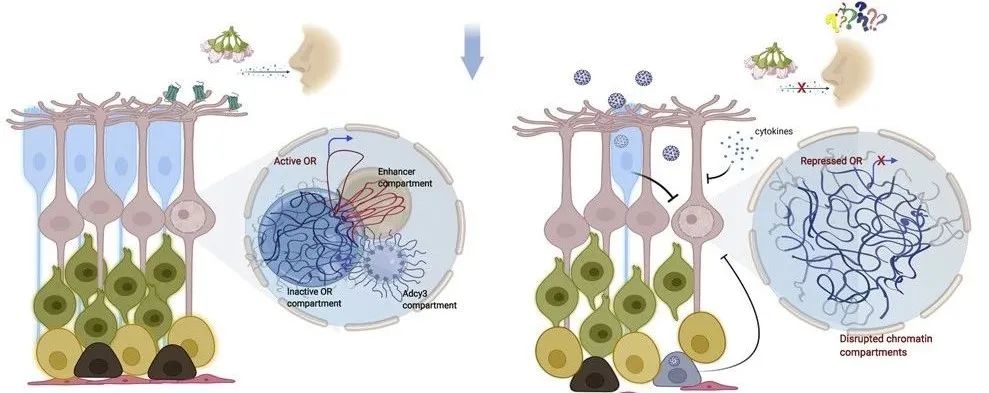
图三 人感染新冠病毒后OSN神经元中OR基因的空间互作发生了紊乱,进而导致基因表达异常(Marianna et al., 2022)
那么OR基因如何在空间上聚簇为一个大的异染色质中心?一个有力的假设是转录抑制的OR基因可能通过异染色质间的相分离(Phase separation)作用聚合。相分离是指拥有相似特征的分子会通过弱的多价相互作用形成生物分子凝聚体,例如经典的核仁结构。更重要的核心问题是,某个OR基因是如何成为“天选之子”的?目前有两种假设(图四):一是“命中注定”(Deterministic model):63个Greek islands中的每一个增强子都能激活一个或多个OR基因,但是只有能同时被hub中的所有增强子激活的OR基因才是被选中的那个;二是“胜者为王”(Probabilistic model):由于异质性的OSN染色质三维结构,随机少数OR基因在Lsd1的作用下偏离于OR异染色质中心,进一步招募增强子和转录因子(Lhx2+EBF)后通过相分离进入增强子中心稳定其表达,随后利用Perk/Atf5因子介导的负反馈通路抑制其它OR基因的表达。尽管单细胞测序证据显示不同OSN细胞可以利用不同的增强子激活相同的OR基因,这表明OR基因的激活不完全由增强子本身决定(即第一种假设)。然而,一些研究发现敲入增强子后附近OR基因被选中激活的概率更高,而对单个增强子的敲除仅影响附近OR基因的表达,这表明OR基因的激活受到多个因素的共同影响,包括增强子、转录因子和染色质开放程度等。实际上,OSN前体细胞和未分化成熟的OSN细胞通常具有多个激活的增强子中心,介导多个OR基因的低水平表达。然而,在成熟的OSN中只剩下一个增强子中心和单个稳定高表达的OR基因。一项去年发表在Nature杂志的研究(Ariel et al., 2023)对这一转变过程提出了RNA介导的对称性缺损(RNA mediated symmetry breaking) 假说:在OSN分化早期,OR基因转录的RNA打破了多个增强子中心的竞争,“随机“保留其中的一个增强子中心而消除其它,随后的OR蛋白通过负反馈固定该选择,从而阻止其它OR(包括假基因)的稳定表达。这也解释了为什么每个成熟OSN在整个生命周期里只表达最初选定的OR基因。
当然,我们目前对于OR基因激活机制的了解仍然存在很多问题:1)每个增强子形成enhancer hub的概率是相似的吗?2)尽管一个OR基因的激活需要邻近增强子介导(cis-顺式)进入增强子中心,对于trans-增强子(即其它染色体上)的选择是完全随机的吗?3)不同的OR亚基因家族(如I型水溶性和II型气溶性)对增强子的选择有偏好性吗?
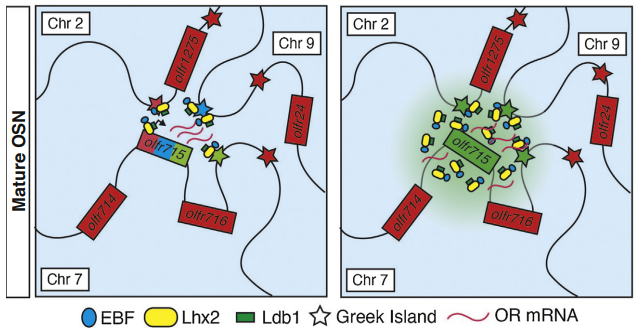
图四 激活OR基因的两种模型(Deterministic and probabilistic models of OR choice;Ariel and Stavros, 2022)
让我们回到最初的问题,为什么不同物种的嗅觉存在差异?从演化角度上回答:OR基因的多少可能决定了嗅觉能力的上限;不同物种中OR基因的启动子-增强子三维调控网络可能存在显著差异。从实际研究出发,我们需要从小鼠和人类的OR基因与增强子的一维序列和三维互作特征中建立模型,应用到非模式物种从而推测整个哺乳甚至脊椎动物的OR基因三维演化模式。
张三和克丽斯·李一样吗?
作为人类,我们更感兴趣的是不同人种或地区之间是否存在显著差异。随着现代人类从非洲走出,征服了世界的各个角落,适应了寒冷干燥的高海拔青藏高原到湿热的低纬度雨林等各种环境,我们可以确定不同地区的人群拥有差异数量的OR基因或增强子。以往的二代测序可能无法适用于这类序列上高度相近的基因家族的研究,但近年来三代测序的广泛应用为更深入解析人类OR基因的演化历史和种群差异提供了良好的机会。除了地域差异,OR基因在性别上可能也存在差异。有研究报道发现女性的嗅觉优于男性。尽管研究人员将这种差异归结于大脑中嗅球细胞数量的差异,但女性多出的一个X染色体上的功能性OR基因(Y染色体上没有OR基因)是否在一定程度上影响了性别上的嗅觉差异也是一个非常有趣的问题。
注:感谢华中农业大学的郑竹清博士对本文的建议。
主要参考文献:
Niimura, Yoshihito, Atsushi Matsui, and Kazushige Touhara. "Extreme expansion of the olfactory receptor gene repertoire in African elephants and evolutionary dynamics of orthologous gene groups in 13 placental mammals."Genome research 24.9 (2014): 1485-1496.
Zazhytska, Marianna, et al. "Non-cell-autonomous disruption of nuclear architecture as a potential cause of COVID-19-induced anosmia."Cell 185.6 (2022): 1052-1064.
Pourmorady, Ariel, and Stavros Lomvardas. "Olfactory receptor choice: a case study for gene regulation in a multi-enhancer system."Current Opinion in Genetics & Development 72 (2022): 101-109.
Pourmorady, Ariel D., et al. "RNA-mediated symmetry breaking enables singular olfactory receptor choice."Nature (2023): 1-8.










