当代生物哲学研讨会(五)宿主与病毒的亿年战争:征服、妥协或和平共处
征服、妥协或和平共处
宿主与病毒的亿年战争
引言
在人类的历史上,曾经爆发过多次传染病的大流行。从古埃及就有记录的天花,到中世纪欧洲的黑死病,以及20世纪初的西班牙大流感,再到近年来爆发的SARS和Covid-19。每一次瘟疫的爆发,都伴随着大量的人口死亡以及社会的巨大动荡,以至于瑞典病理学家Folke Henschen做出评价:“人类的历史即是疾病的历史。”

图1 人类历史中曾出现的大流行病
图源:视觉资本
事实上,不仅是人类社会,病原体对自然界的生物也存在巨大的影响。宿主在演化中不断形成新的抗病性状,而病原体也在演化中不断增强入侵宿主的能力,这样的“军备竞赛”在自然界随处可见。在这个过程中,不能够跟上节奏的一方会被淘汰,从而驱动宿主和病原体的共演化。可以说,自然界的演化历史就是一部宿主与病原体的战争史。
然而,对病原体而言,宿主死亡往往也意味着自身的死亡,因此,从演化的视角看,病原体产生强毒力似乎是不合道理的。在Covid-19流行的期间,很多人也都相信病毒最后必然会无毒化。但另外也有一群人认为Covid-19病毒会保持一定的毒力,对人类造成持久的损害。而对医学发展乐观者则相信,人类最终必将征服Covid-19,将病毒彻底消灭。宿主与病毒之间的关系究竟会怎么发展,其终点又会是什么?
1
难分胜负的战争
在谈论病毒与宿主的关系之前,我们首先讨论宿主和病毒可能的演化终点。在这场战争中,最后的终点可能是以下几种情况之一:①宿主彻底消灭病毒②病毒导致宿主灭绝并转移到新的宿主③病毒保持毒力并与宿主长期共存④病毒与宿主共生但毒力完全消失。前两种情况我们可以称为征服、第三种情况我们称为妥协、第四种情况我们称为和平共处。其中,针对毒力这一不易定义的概念,我们也可从适应度的角度出发,对妥协和共存做一个清楚的区分:如果一种病毒对宿主的综合影响会降低宿主的适应度,这种情况我们将它定义为妥协;反之如果在病毒通过寄生得以存活的过程中,它对宿主的综合影响是提升或不改变其适应度,那么就认为是和平共处的关系。
但是对于征服这一情况,它带有十分强烈的主动性,很难在自然界中对它进行一个清晰的定义。在自然界,由于病毒变异能力太强,往往能够很快产生适应宿主免疫系统的变异,因此极少有宿主征服病毒的案例,只有在人类社会可以通过发达的医学技术实现对病毒的征服。根据世界卫生组织的定义,当我们能够将一种病原体的传播力永久地保持在零,我们就认为这种病毒被消灭了。在历史上,也只有以下三种病毒符合这一情况:天花病毒、脊髓灰质炎病毒和牛瘟病毒。
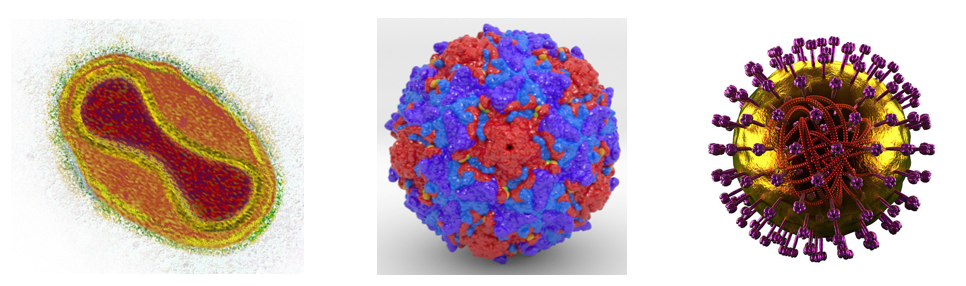
图2 天花病毒、脊髓灰质炎病毒和牛瘟病毒。
图源:Kenneth、biologic、iStock
相反,病毒征服某个宿主的例子却大量存在。上个世纪90年代,印度的格里芬兀鹫突然大量死亡,在短短十年内数量下降了90%以上,几乎功能性灭绝。科研人员对死去的兀鹫尸体进行病理学分析,认为很有可能是某种病毒导致兀鹫的大量灭亡[1]。然而,瘟疫虽然是物种灭绝可能的推手,但很少有瘟疫单一因素导致的物种灭绝。
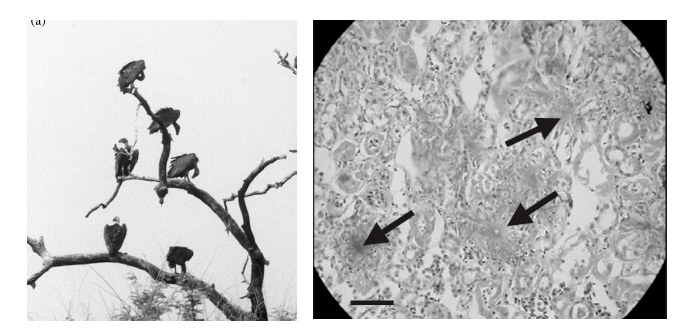
图3 大规模灭绝的格里芬秃鹫(左)
秃鹫尸体的病理切片(右)[1]
2
无毒化共存的思潮:
病毒与宿主的Happy Ending?
考虑到宿主的灭绝往往导致病毒的灭绝,以及人类医学在人类历史中的特殊性,我们有理由相信,在宿主和病毒的种间关系方面,彻底征服是一道对双方都有害的深渊,是自然历史上少有的特殊案例。
事实上,学术界长期存在这样的普遍认知,很早就有科学家提出了病原体和宿主最后会趋于互利共生的假说。在19世纪后期,比利时古生物学家Pierre-Joseph van Beneben在他的一部专著Animal parasites and messmates 中,第一次提出了“互利共生”的概念[2],并首次提出了无毒化的模型。
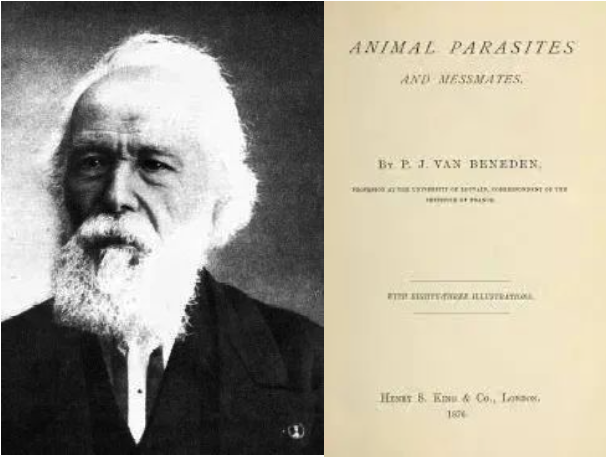
图4 Pierre-Joseph van Beneben(1809-1894) 与他的专著Animal parasites and messmates[2]
而第一个系统性提出无毒化假说并获得广泛认可的人是美国的细菌学家Theobald Smith。他认为,从演化的观点来看,一个微生物越是有毒,就会越快导致宿主死亡,进而它从宿主身体中传播出去的概率就会降低,这就使得致死性太强的细菌会被那些温和的细菌所取代。长此以往,最后细菌的毒力就会向无毒化演变[3]。他研究了美国得克萨斯牛热病的例子,发现北方的牛受到蜱虫叮咬会感染牛热病,而南方的牛则不会,他认为是因为南方的牛长期受到蜱虫影响,双方达到了一个共存的“平衡点”,才会实现病原体的无毒化[4]。

图5 Theobald Smith(1859-1937)与关于病毒毒力研究的Science论文
从演化生物学的角度来看,这个观点很符合直觉,因而在当时的演化生物学家中间很受欢迎。现代综论的早期创立者们,如赫胥黎、杜布赞斯基、恩斯特·迈尔等人总体都支持这一观点。但是当时演化生物学对共生关系讨论还是比较少,他们的工作本身也往往不涉及这些内容,因此毒力下降假说一直没有得到直接的证明。
3
澳洲野兔粘液瘤病毒之谜
——低毒力的trade-off模型
上世纪中叶,澳大利亚兔子泛滥成灾,当时政府决定采纳利用粘液瘤病毒来控制兔子数量的方案。当时参与这项计划的一名科学家Frank Fenner发现,起初粘液瘤病毒发生了毒力下降,第一年的致死率高达99.8%,但是第二年致死率就只有90%了,之后的几年也在逐年下降。起初这看起来是毒力下降假说的又一力证,然而,过了几年后,粘液瘤病毒毒力似乎平稳了下来,保持在中等的致死率。Fenner提出,在短期内,病毒和宿主的共演化并不一定导致无害寄生关系[4]。

图6 Frank Fenner(1915-2010)(左)
澳大利亚野兔大爆发(右)
而进一步对毒力下降假说提出批判的,是另一群精通数学的演化生物学家和生态学家们。Gillespie是其中的先驱,他最早提出显性遗传模型,结合流行病学知识,从群体遗传学的角度去研究抵抗流行病的基因。Gilespie假设了一个单倍体宿主群体,探索一个基因有两个等位基因的情况,一种基因对特定疾病有抵抗力,但是适应度较低。在这样的种群中,抗性和易感性宿主会达成一定的平衡,在宿主层面,会达成易感/抗病的基因多态性[5]。除此之外,Kember、Simon Levin、 David Pimentel等人也通过不同的数学建模手段,均获得了类似的结果,即宿主和病原的共演化未必使致死率趋于0[6]。
更加著名的是Robert May和Roy Anderson提出的Trade-off模型[7]。他们通过数学模型,将表示病毒传播能力的R0化为了这样的一个表达式:
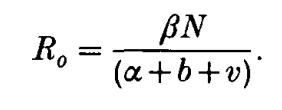
其中α为疾病导致的额外致死率,b是群体正常死亡率,v是恢复率,β是传播率。根据这个等式,看上去降低疾病死亡率提升了R0,应该受到选择的偏好,但是实际上,额外死亡率和恢复率显然是呈负相关的。通过数据统计与拟合,他们得到了两种拟合的额外死亡率与恢复率的关系式,将这两个v(α)代入后,它们发现,R0出现了一个低毒力(不是0毒力)峰值,而这和在各个地方的实际情况是吻合的。
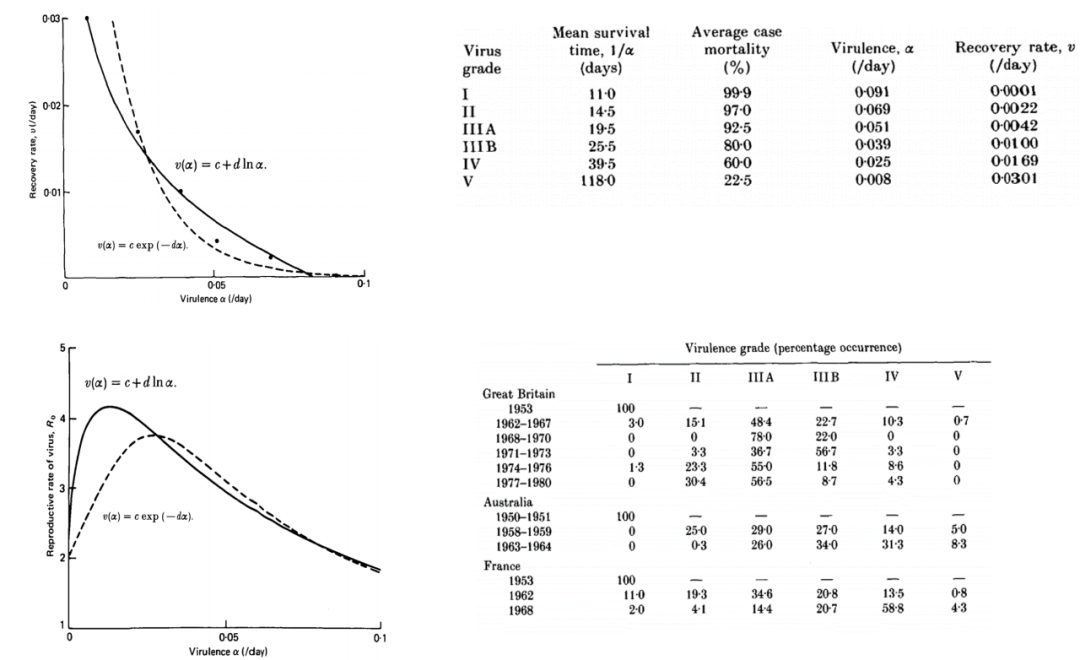
图7 Trade-off模型的模拟与实际数据
左图中的实线和虚线代表两种不同的恢复率-毒力模型拟合结果的模拟,从左下图中可以看到一个低毒力的高适应度峰值。右图为实际数据表,可以看出在各个地点,最终都是较低毒力的毒株占优势。
May和Anderson的模型似乎表明,作为一种病原体,病毒最后会保持对宿主的一个较低的有害性。但是实际上,他们的模型中有一部分前提假设是不符合大多数病毒传染的特点的,包括只能在单一物种中传播、一次感染终身免疫等。但是由于其模型框架的普适性,至今仍有不少人基于trade-off模型进行扩展,使其更好适应复杂的现实情况。
4
复杂种间关系带来共存希望
根据Robert May等人提出的trade-off模型,病毒会朝着低毒化的方向演化。事实上,除了这样的结局之外,自然界中还存在着许多宿主与病毒形成共存关系的例子(图8),其中病毒大多可以为宿主提供一些有利因素以提升其适应度[8]。并且我们可以预见,如果环境不发生剧烈波动,这样的共存,似乎可以看作是演化历程中更加稳定的一种形式。这里我们以一种真菌病毒和一种多DNA病毒,分别从共生和基因组内源化的角度来展现病毒与宿主共存的现象。
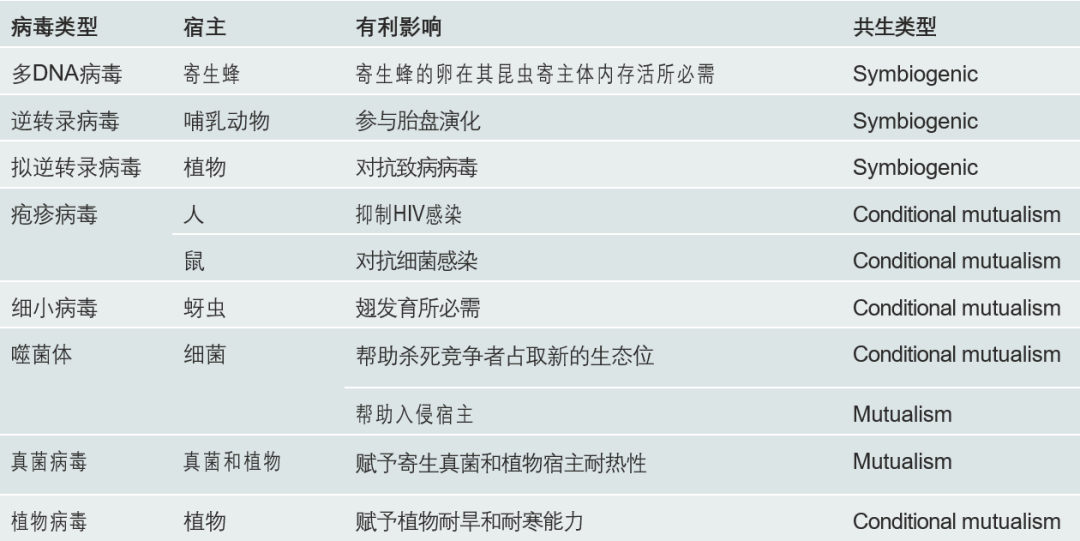
图8 病毒-宿主共生的类型[8]
共生类型定义:
Mutualism:对参与共生关系的所有角色都有益;
Symbiogenic:通过共生关系与宿主融合形成新的物种
最初在2002年,华盛顿大学植物系的Regina等人,在拉森火山公园和黄石国家公园收集了200份莲座黍属物种的样品,纯化到了一种新的弯孢菌属真菌,并发现它与植物的共生是使得二者在高温下存活的基础,证明了其对提升植物的环境适应性的显著贡献[9]。
随后Luis等人对这一现象进行了更加深入的研究,发现这种共生关系下的抗高温能力实际上来源于一种与真菌共生的病毒[10]。研究构建了四类植株:野生组、去病毒组、去共生真菌组、重新接种病毒组。研究结果表明,去除病毒后的菌株不再能为植株提供抗高温的能力,而重新引入这一病毒,菌株又可以重新为植株提供抗高温能力。并且在番茄中引入这一携带共生病毒的真菌后,番茄同样获得了抗高温的能力。
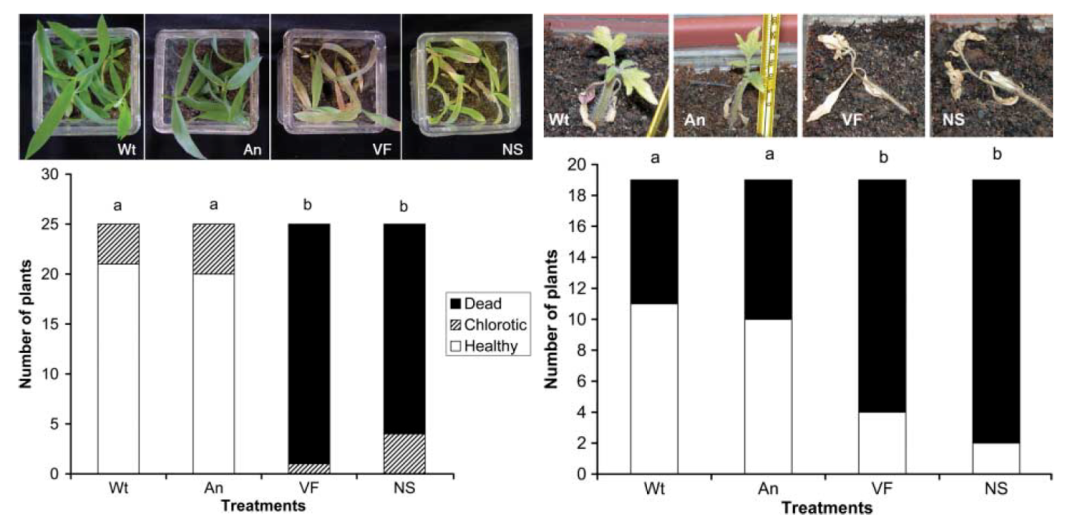
图9 病毒为植物和真菌提供抗高温的能力[10]
Wt:野生组;An重新接种病毒组;
VF:去病毒组;NS:去共生真菌组
总的来说,病毒、真菌、植物三者可以形成一个互利共生的体系,共同对抗高温。这种关系是如何建立的尚不清楚,但这一现象表明存在一些病毒,可以凭借自身快速演化的能力,以获得对环境更高的适应性,从而帮助植物提升其适应度以适应极端和剧烈变化的环境。
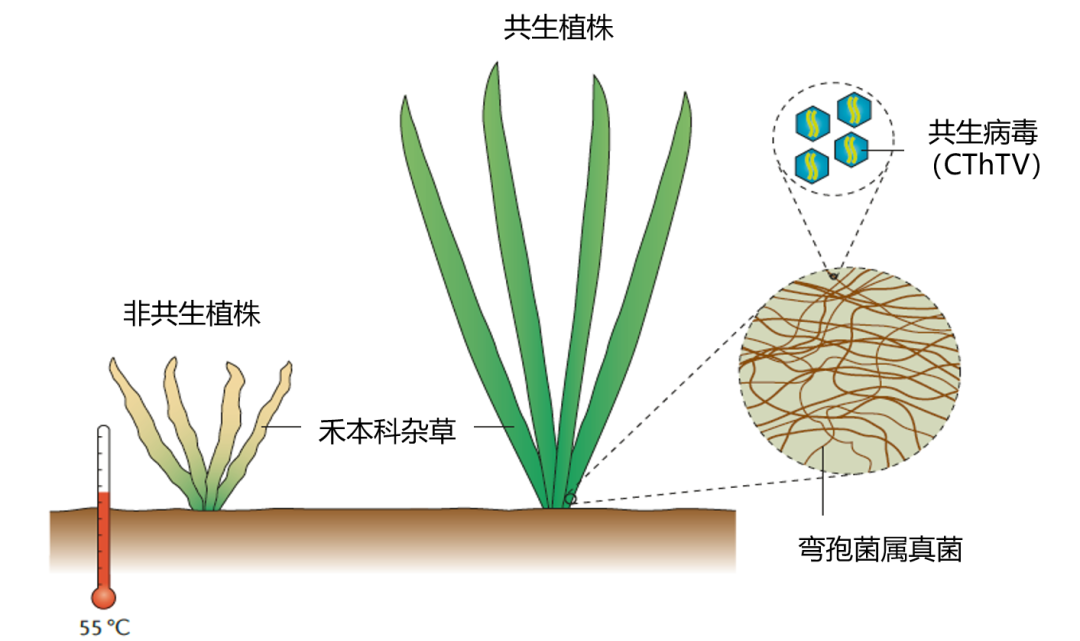
图10 病毒、真菌、植物互惠共生[8]
5
共存?征服?
充满谜团的病毒内源化
事实上,现存的许多物种基因组上都有病毒基因组的痕迹。例如名为HERV-K (HML-2)的内源性逆转录病毒在当今人类基因组、尼安德特人基因组和丹尼索瓦人基因组中都有发现,说明其对应的逆转录病毒已经出现在人类共同祖先上。这里,我们以一种保存得十分完整,但又几乎已经完全被宿主利用的多DNA病毒的例子来说明,一部分病毒以内源化的形式与宿主形成了类似共存的关系。
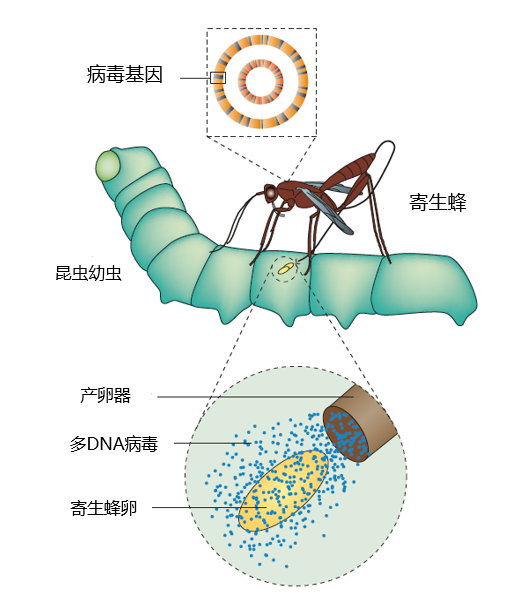
图11 多核苷酸病毒与寄生蜂、鳞翅目幼虫[8]
寄生蜂会将卵产到其他昆虫幼虫的体内,这些卵会在宿主体内发育到幼虫或成虫阶段,然后从宿主体内钻出。这一个过程势必涉及到二者的博弈,而一类多DNA病毒(nudivirus)恰巧在这个过程中帮助寄生蜂取得了阶段性的胜利。这类病毒的基因组已经完全整合进了昆虫的DNA中,并且仍然保持着完整的结构域以及一些病毒特有的RNA聚合酶,一些寄生蜂正是靠着这些病毒粒子所携带的宿主基因去阻碍鳞翅目幼虫的排斥反应,如果没有这一阻遏过程,寄生蜂的卵将无法在幼虫体内存活[8]。
针对这类多DNA病毒的来源,Jean-Michel Drezen等人发现一种茧蜂基因组中的多DNA病毒来源于一种原始的裸杆状病毒(nudivirus)[11]。通过检测病毒相关基因的表达情况,他们发现病毒基因不仅会被转录,而且它的调控序列也还发挥着调控自身基因的作用。寄生蜂与多DNA病毒的共生很好地说明了,宿主结合了病毒基因的复杂机制,使其自身基因能够在靶生物中转移和表达。
2018年,佐治亚大学昆虫学系的Gaelen R. Burke发现,一种来源于致病性病毒(α-nudivirus)的基因组被整合进一种寄生于橘小实蝇的茧蜂中,并迅速发生了基因丢失、基因组结构和表达变化等事件,使得寄生蜂能够组织特异性地产生病毒颗粒并向宿主大量传递,帮助寄生过程[12]。
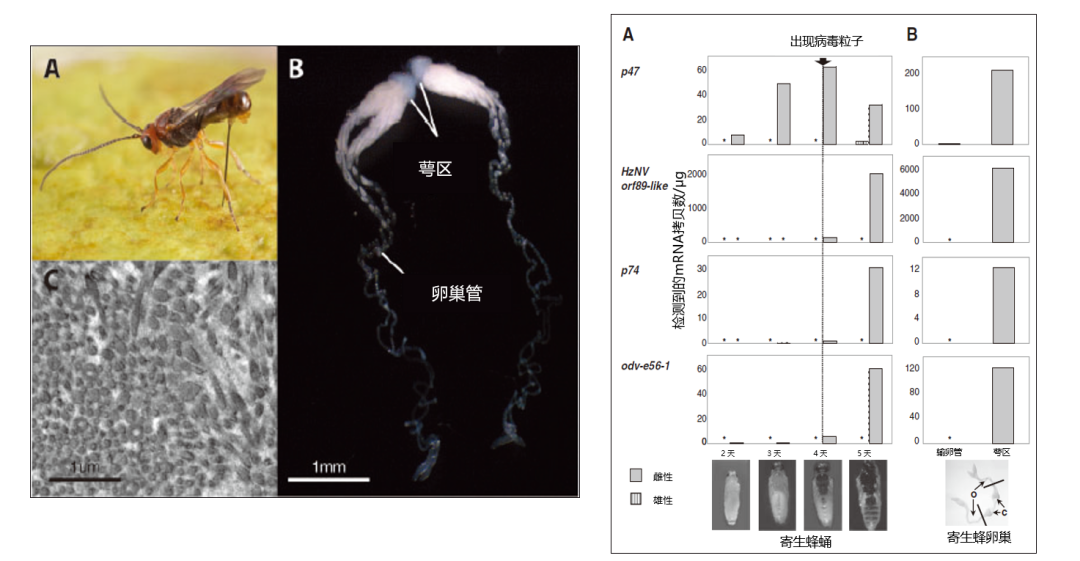
图12 左:整合进寄生于橘小实蝇的茧蜂基因组的病毒[12] 右:茧蜂基因组中病毒相关基因的表达情况[11]
当然,在这样一种特殊的情况下,它是否还能被称作病毒也一直存在争议。但是我们可以确认的是,在整合之初,这是一种昆虫致病病原体,随后整合进宿主的序列随着宿主的传代迅速演化。同时这些序列还保持着调控自身基因的能力,也会被转录形成一个独立的病毒粒子,并为宿主快速适应环境和提升适应度提供了很重要的帮助,所以可以将其视作病毒与宿主共存的一种形式。但是在很多内源性病毒的例子中,病毒的基因组已经变异得和本来完全不同了,也不能形成完整的病毒颗粒了,在这种情况下,这样的内源性病毒还能称为共存吗?抑或是宿主对病毒温水煮青蛙式的征服呢?这一问题就如同忒修斯之船,难以得出一个确定性的结论。
6
病原体与宿主共演化的新视角:
适应度景观的探索
事实上,如果对演化过程换一种视角来看,实际上就是在把遗传物质传递给下一代的过程中,通过携带不同的变异,探索不同基因序列的生存、繁殖能力,并选出其中最优的一个。我们可以把这样的一个过程,视为对序列高维空间的不断探索,而每一个不同的序列具有不同的生存与繁殖的能力,构成了一个适应度的景观。
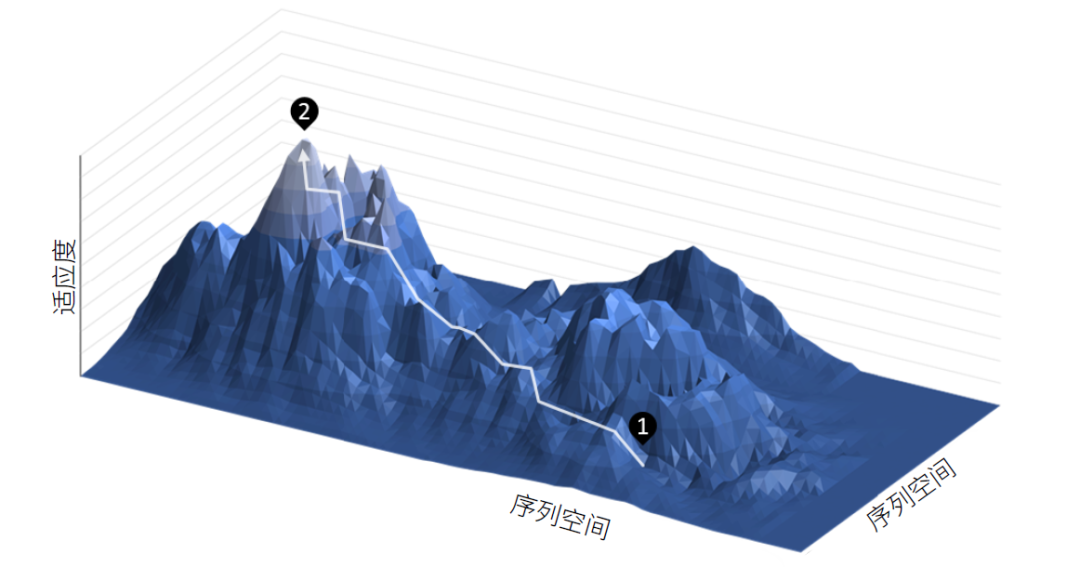
图13 序列空间的适应度景观
图源:https://www.rhyslindmark.com/fitness-landscapes/
让我们来假设,在环境不变的情况下,病毒的适应度景观应当也不发生改变,那么在足够长时间下,病毒能够走遍整个序列空间并达到最优解吗?答案是否定的,因为存在选择压力,各种类型的生殖能力不同,一些类型的病毒甚至无法传代,这样,在病毒突变能力有限的情况下,只能达到一个所能达到的序列空间中的相对最优解。而这一相对最优解是和宿主互利共生还是保留毒性,受到病毒本身性质以及初始序列的影响。此外,随着寄主自身序列的改变,病毒所处的适应度景观也在发生改变,使得这一问题更加复杂,也更加难以得出一个确定的结论。
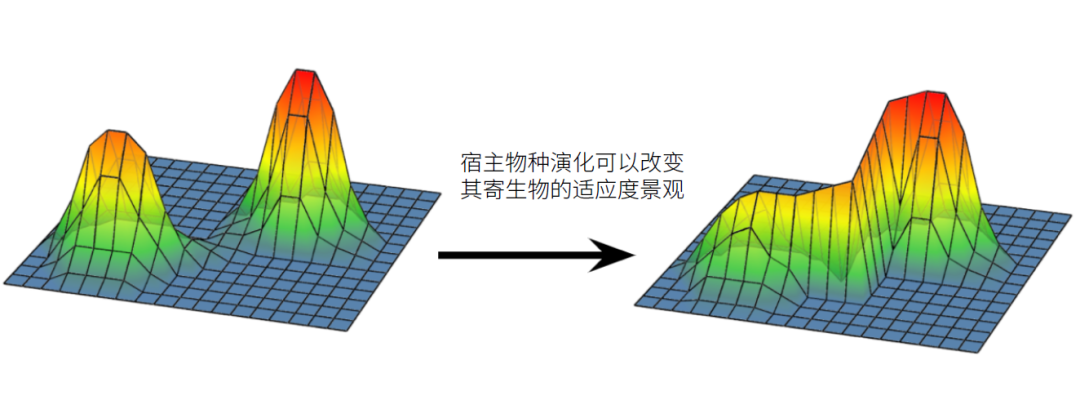
图14 宿主的演化改变寄生物的适应度景观
图源:https://labs.biology.ucsd.edu/meyer/no-sidebar.html
7
不平衡战场的不确定结局:
在世界中心呼唤医学
宿主和病毒的共演化关系如此复杂,无法在征服、妥协或和平共处中做一道选择题。从最初认为的必然走向无毒化共存,到基于流行病学模型的低毒力妥协,再到各种复杂实际情境中难以预测的情况,病毒和宿主的关系实际上充满了不确定性。
但是,在这不确定性中,有一件事是确定的,那就是在自然条件下,病毒在适应性方面具有绝对优势。由于病毒极短的代际交替以及极快的变异速度,它们往往能够快速适应宿主而宿主却无法快速适应病毒。这使得宿主想在正面战场征服病毒成为了一件几乎不可能实现的事情。
然而对于人类来说,却有自身适应性变异以外的“第二战场”。正如一开始提到的,人类三次征服病毒,依靠的是医学的发展。无论是流行病学上的隔离与疫苗接种,还是新型的抗病毒药物的发明,甚至是兽医学的发展,人类通过自己的智慧加速了宿主对病毒的适应,让病毒和人类在变异方面的军备竞赛成为了和医学的军备竞赛。随着人工智能技术在制药领域的应用,可以预见的是,医学将会使人对病毒的“适应性演化”越来越快,可能终有一天,将会是病毒的变异跟不上医学的发展,人类才能在这场亿年战争中获得主导权。
参考文献
[1] Cunningham, A. A., Prakash, V., Pain, D., Ghalsasi, G. R., Wells, G. A., Kolte, G. N., … Rahmani, A. (2003). Indian vultures: Victims of an infectious disease epidemic? Animal Conservation, 6(3), 189–197. doi:10.1017/s136794300300324x
[2] Joseph, V. B. P. (1889). Animal parasites and messmates. London: Paul, Trench.
[3] Smith, T. (1904). Some problems in the life history of pathogenic microorganisms. Science, 20(520), 817–832. doi:10.1126/science.20.520.817
[4] Méthot P. O. (2012). Why do parasites harm their host? On the origin and legacy of Theobald Smith's "law of declining virulence"--1900-1980. History and philosophy of the life sciences, 34(4), 561–601.
[5] Gillespie, J. H. (1975). Natural selection for resistance to epidemics. Ecology, 56(2), 493–495. doi:10.2307/1934983
[6] Levin, S., & Pimentel, D. (1981). Selection of intermediate rates of increase in parasite-host systems. The American Naturalist, 117(3), 308–315. doi:10.1086/283708
[7] Anderson, R. M., & May, R. M. (1982). Coevolution of hosts and parasites. Parasitology, 85(2), 411–426. doi:10.1017/s0031182000055360
[8]Roossinck, M. J. (2011). The good viruses: viral mutualistic symbioses. Nature Reviews Microbiology, 9(2), 99-108.
[9] Redman, R. S., Sheehan, K. B., Stout, R. G., Rodriguez, R. J., & Henson, J. M. (2002). Thermotolerance generated by plant/fungal symbiosis. Science, 298(5598), 1581-1581.
[10] Márquez, L. M., Redman, R. S., Rodriguez, R. J., & Roossinck, M. J. (2007). A virus in a fungus in a plant: three-way symbiosis required for thermal tolerance. science, 315(5811), 513-515.
[11] Bézier, A., Annaheim, M., Herbinière, J., Wetterwald, C., Gyapay, G., Bernard-Samain, S., ... & Drezen, J. M. (2009). Polydnaviruses of braconid wasps derive from an ancestral nudivirus. science, 323(5916), 926-930.
[12] Burke, G. R., Simmonds, T. J., Sharanowski, B. J., & Geib, S. M. (2018). Rapid viral symbiogenesis via changes in parasitoid wasp genome architecture. Molecular biology and evolution, 35(10), 2463-2474.










