当代生物哲学研讨会(四)探索真核生命的起源之迷:一场演化生物学的壮丽征程
一场演化生物学的壮丽征程
探索真核生命的起源之迷
从长白山脉中的形形色色的飞禽走兽到大堡礁中千姿百态的鱼虾蟹贝,从亚马逊雨林中层层叠叠的木草藤棘到腾格里戈壁上缉缝钻营的蛇虫鼠蚁,勃勃生机、万物竞发的地球在广袤的宇宙之中显得如此与众不同。这一切的奥秘都在于17亿年前,地球生命经历的一次飞升般的蜕变——真核生物的起源。
地球上最早的生命诞生于距今38亿年前,原始的生命已经悄然出现在海底热泉喷口。此时的生命形态极其简单,它们只是由酯键连接的脂肪酸双分子层包裹着一滩包含着遗传物质(DNA和RNA)的缓冲液而已。它被称为LUCA(Last universal common ancestor),是地球上所有生命的共同祖先[1]。随后,LUCA的后代继承了它的简单细胞形态并散布于地球上的每一个角落,这些生物被称为原核生物(Prokaryotes)。此时的生命在宏观上看来可能只是一层层不同质地和颜色的菌毯。地球上的生命在这种单调的形态下维持了至少20亿年。直到17亿年前,结构非常复杂的细胞才出现在地球上[2]。除了原核细胞也有的结构以外,这些细胞内还存在着由脂质膜形成的复杂内膜系统(包括高尔基体、内质网等),线粒体、叶绿体等细胞器,它们的遗传物质也被核膜保护起来。这些细胞被称为真核细胞(Eukaryotic cells)。目前已经发现的所有大型有机体(Macroorganisms),无论是植物、动物还是蘑菇等真菌,都由这些细胞组成。因此也被称为真核生物(Eukaryotes)。真核细胞起源无疑是地球上生命出现以来最复杂的也最困难的演化变化[3]。这可能也是为什么这一转变需要如此漫长的演化历程的原因。更重要的是,真核起源给生命带来了无与伦比的丰富演化潜力。正因如此,真核起源引起了大量演化学家的兴趣,他们穷尽各种手段试图一窥演化历程的究竟。然而, 20亿年的岁月砥砺足以掩埋了这一重要演化历程的蛛丝马迹。在探索真相的过程中,演化生物学界陷入了一场涉及数十种假说、几百篇论著、上千名研究者参与其中的大论战。本文试图从庞杂的信息中理出一些脉络,回顾人类认识地球生命演化史诗中重要篇章的艰难历程。
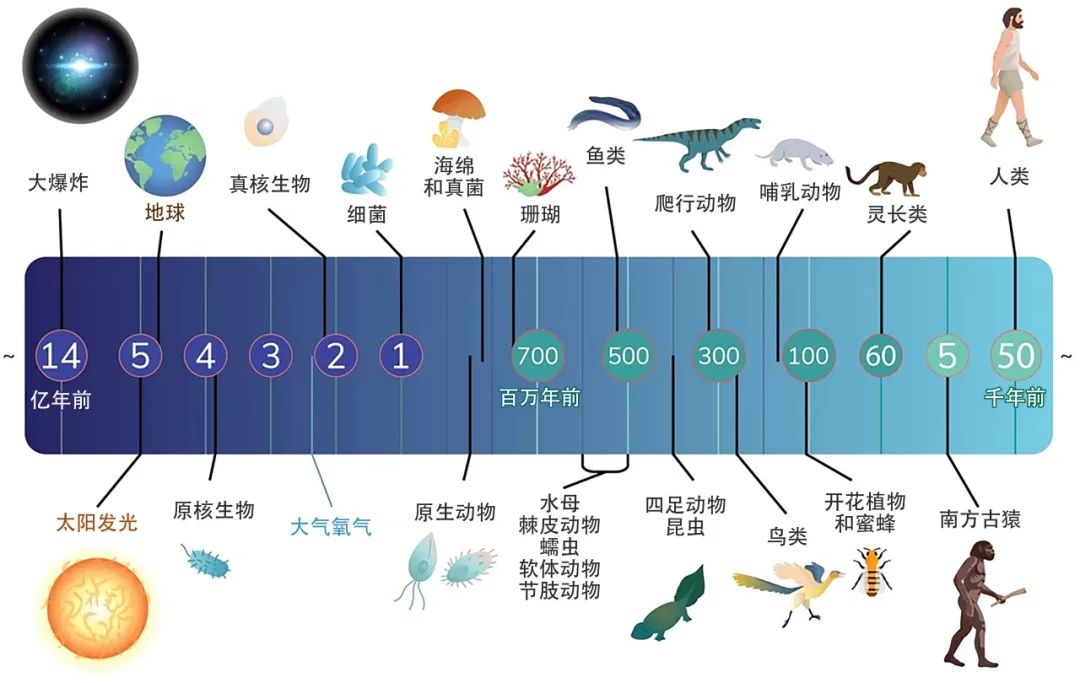
图一 生命演化历史简述
图源: Shutterstock
生命分类的最基本结构
——三域系统与两域系统之争
01
原核生物是最早被人类发现的生物,早在1676年,显微镜之父安东尼·范·列文虎克(Antonie van Leeuwenhoek)就观察到了这些微小而简单的生物,并将它们称为细菌(Bacteria)。1925年,法国生物学家埃德·查顿(Édouard Chatton)首次提出了原核生物(Prokaryotes)和真核生物(Eukaryotes)的二分法,也就是双超界系统(two-superkingdom system)。他认为,原核生物和真核生物在细胞水平上的差异是根本性的,远远超过了原生生物、植物和动物之间的差异。这一分类方法后来被广泛接受,成为了科学界的共识,也被写入了世界各地的教科书,成为了人们的“常识”。
然而,随着科学技术的进步,越来越多的原核生物被发现,微生物学家们发现,原核生物之间的差异也非常巨大,以至于很难根据形态和结构特征来构建它们的系统发育关系。有些分类学家甚至认为,原核生物的系统发育是不可能实现的[4]。
当然,并不是所有的科学家都放弃了对原核生物的研究。1966年,美国分子生物学家卡尔·乌斯(Carl Woese)开始使用一种名为寡聚核苷酸编目(oligonucleotide cataloging)的繁琐实验技术,来分析细菌的rRNA分子的序列。经过十年的艰苦努力,他终于发现了一些产甲烷菌(methanogens)的rRNA序列与其他细菌完全不同,它们不属于细菌,而是一种全新的原核生物——古菌(Archaea)[5]。同时,他还发现,古菌与真核生物的亲缘关系比细菌更近。
这一惊人的发现引起了科学界的轰动,也遭到了很多的质疑和反对。乌斯经历了长达十年的冷遇和批评,直到他的研究被越来越多的证据所支持,才得到了广泛的认可。他的发现后来发展为细菌-古菌-真核生物三域系统(three-domain system)。在该系统中,生命最早分化出细菌分支,然后才是真核生物和古菌的的分道扬镳。
不过三域系统并不是没有争议的。一些科学家提出了两域系统(two-domain system)来挑战它。两域系统的思想最早来源于加州大学洛杉矶分校的演化生物学家詹姆斯·莱克(James A. Lake)提出的黎明细胞假说(eocyte hypothesis)[6]。该假说认为,生命应该分为原核生物(Parkaryotes)和真核生物(Karyotes),其中真核生物的祖先是一种依赖硫的细菌,被称为黎明细胞(eocytes)。在乌斯提出使用rRNA序列来鉴定原核生物的类别之后,一些科学家发现,所谓的黎明细胞其实是一种古菌。因此,他们修改了黎明细胞假说。新的假说认为,细菌是最早与其他生物分开的,但真核生物并不是古菌的姐妹群,而是深深嵌入在某一个古菌的分支内,也就是说,所有的真核生物都是古菌的一种。这就是“两域系统”。
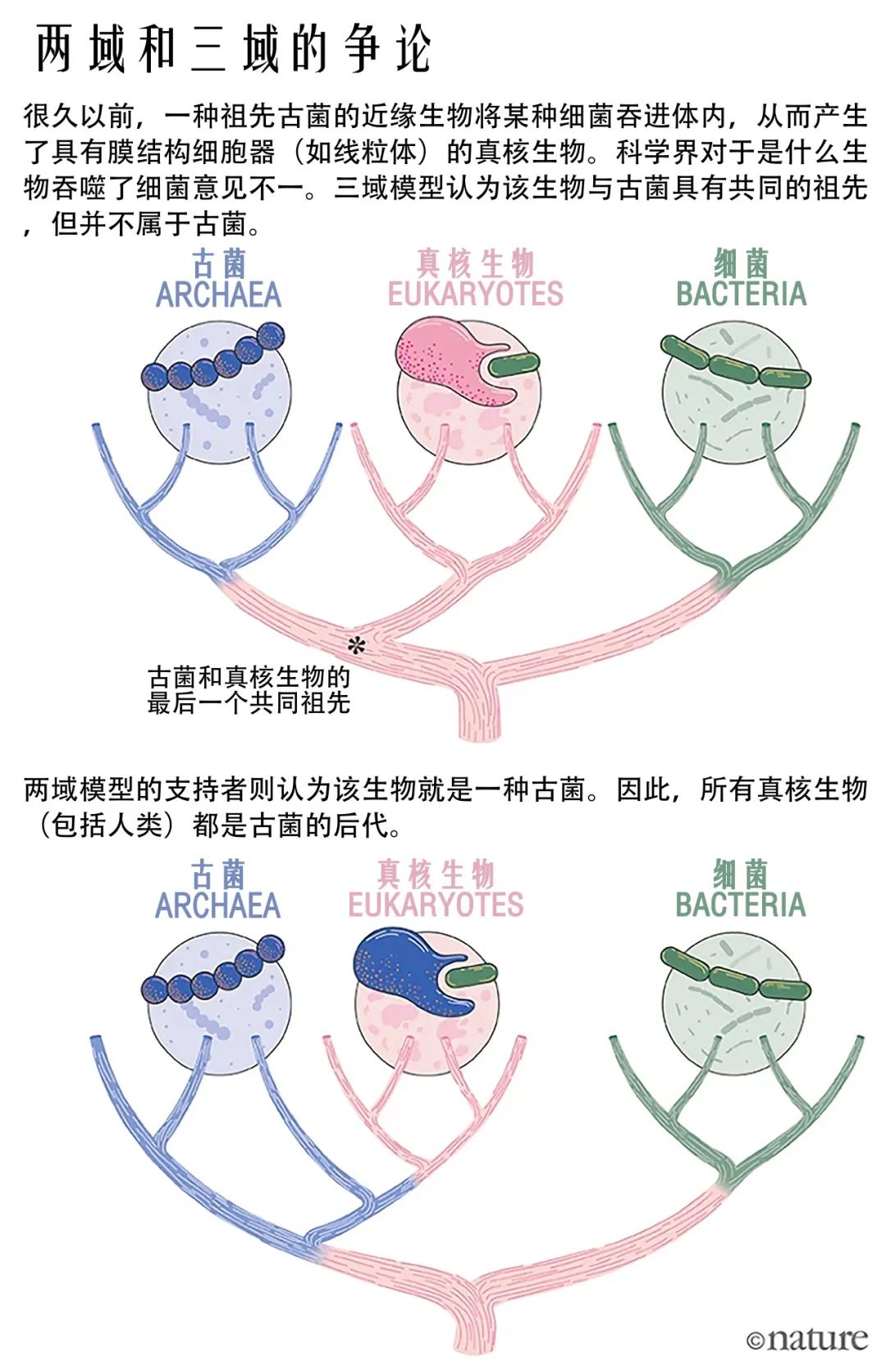
图二 三域系统与两域系统之争
(Watson, 2019, Nature.)
内共生与线粒体起源
02
人类对于叶绿体和线粒体的起源有着悠久的探索历史。早在1883年,德国植物学家安德烈亚斯·辛珀(Andreas Schimper)就发现了绿色植物中的叶绿体与自由生活的蓝藻的相似性,并提出了绿色植物可能是由两种生物内共生而成的假说。1918年,法国科学家保罗·朱尔斯·波蒂尔(Paul Jules Portier)也对线粒体提出了类似的内共生起源的假说。然而,这些假说缺乏直接的证据,一直没有得到广泛的认可。
直到1960年代,美国演化生物学家林恩·马古利斯(Lynn Margulis)通过比较叶绿体和线粒体的细胞超微结构,发现它们与某些细菌有着惊人的相似性,从而为内共生起源的假说提供了有力的支持[7]。她的研究引起了科学界的关注,也激发了更多的实验和理论的探索。经过与其他竞争性假说的比较和检验,内共生起源的假说逐渐成为了科学界的共识。
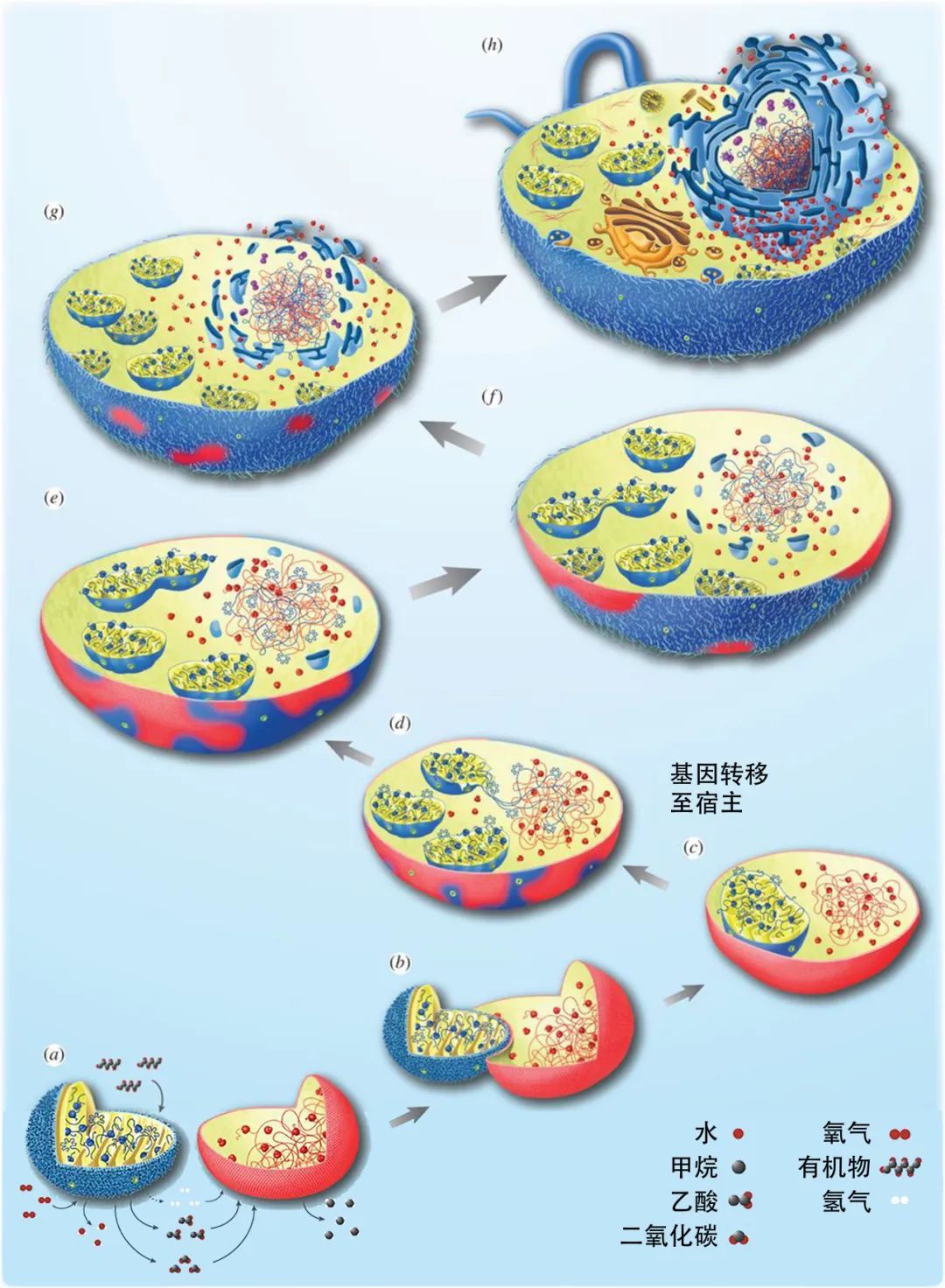
图三 线粒体的内共生起源假说[8]
分子生物学和现代DNA测序技术的发展,为确定线粒体的自由生物祖先提供了更加精确和可靠的方法。2004年,美国微生物学家威廉·马丁(William Martin)通过大规模地测序和比较线粒体和细菌的基因组,确认了线粒体的祖先是一种属于α变形菌(Alphaproteobacteria)的细菌[9]。他还发现,在内共生的过程中,内共生体的基因大量地转移进了宿主细胞的核基因组,从而改变了宿主细胞的基因组结构和功能。随后,更多的研究表明,线粒体的祖先具体来自于α变形菌纲下的远洋杆菌目(Pelagibacterales)。这些细菌是一类体积极小(<0.7 μm)的浮游细菌,是海洋系统中最丰富的细胞群,也可能是地球上数量最多的细菌。α变形菌作为内共生体,可能为宿主提供了在氧气环境下生存的能力,以及高效的能量代谢。这使得内共生具有了巨大的演化优势。
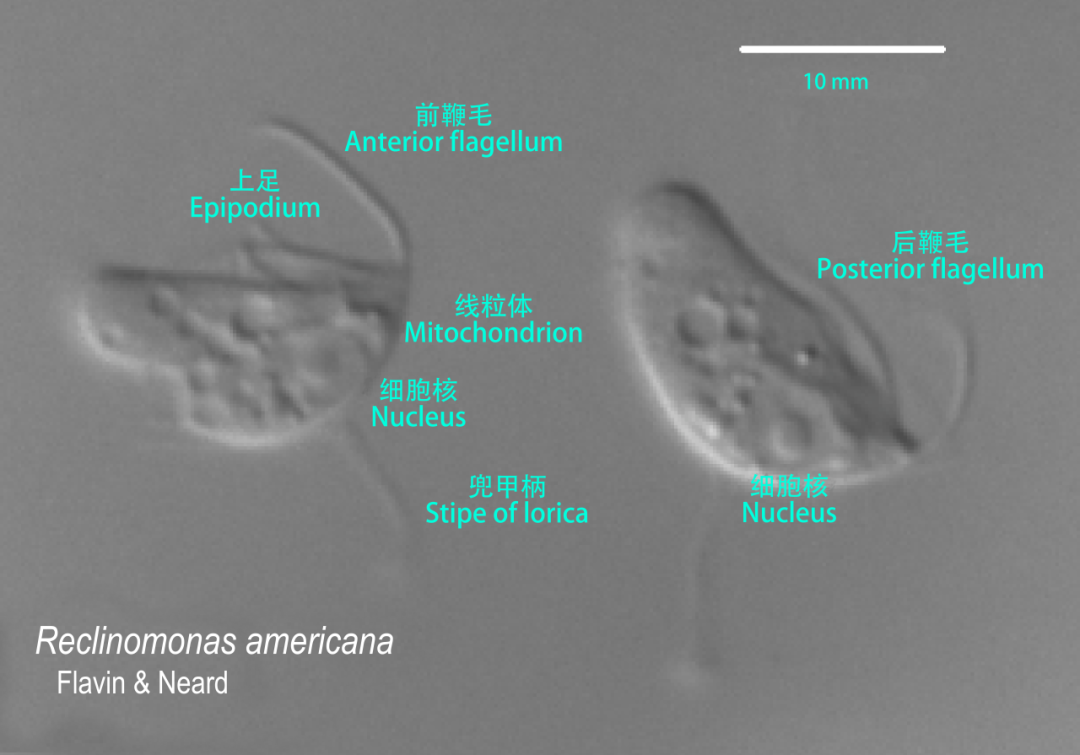
图四 线粒体祖先的现生后裔
(Reclinomonas americana)
图源:umontreal.ca
阿斯加德古菌的发现
03
科学家们在寻找线粒体祖先的同时,也试图找到可能的宿主细胞祖先。但是,尽管有很多证据支持古菌宿主的假说,生物学家们却很难确定宿主祖先具体属于哪个古菌分支。直到2015年,瑞典乌普萨拉大学的演化微生物学家泰斯·埃特玛在格陵兰海底的一处名为“洛基城堡”的热液喷口附近的泥浆中发现了一种全新的古菌,他们将其命名为洛基古菌门[10]。随后,科学家们在世界各地的海底极端环境中都发现了与之相似的古菌,如索尔古菌门、奥丁古菌门等,统称为阿斯加德古菌超门。通过对这些古菌的宏基因组分析,科学家们发现真核生物与阿斯加德古菌有着非常紧密的亲缘关系,尤其是海姆达尔古菌门之下的霍德尔古菌亚门。这项研究有力地证实了两域假说的正确性,并引起了全球媒体的广泛关注。埃特玛的数据非常详尽,分析方法也十分可靠。虽然也有一些三域假说的支持者怀疑他们的样品可能被污染,但这并没有影响这一发现得到了学术界的普遍认可。

图五 阿斯加德古菌的发现
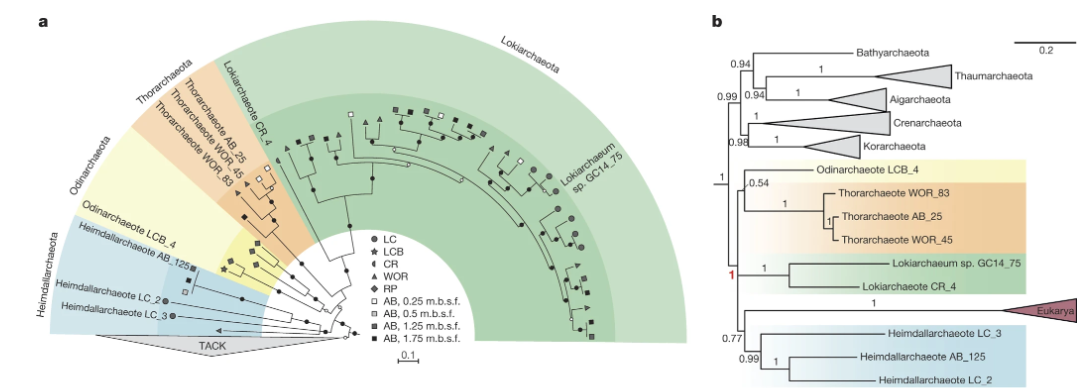
图六 阿斯加德古菌基因组测序揭示了真核生物的祖先类群系统发育[10]
如今,科学家们已经清楚地认识到内共生是真核起源的关键因素,并明确了内共生是发生在细菌内共生体和古菌宿主之间的。值得注意的是,真核细胞和古菌在涉及中心法则的基本结构的蛋白质序列上有着很高的相似度,例如组蛋白和与DNA复制相关的酶等。然而,真核细胞的细胞膜和内膜系统都是由甘油酯组成的,与细菌的细胞膜相同,而不是古菌特有的甘油醚型细胞膜。有科普作家曾形象地将真核细胞比喻为“穿着细菌外套的古菌”。为了探究真核起源的具体过程,科学家们提出了两个概念:第一个真核祖先(FECA)和最后一个真核祖先(LECA)。因此,要彻底解决真核起源的问题,就是要回答从FECA到LECA的演化过程中到底发生了什么。
真核起源的热力学悖论
04
真核生物的起源是一个复杂而有趣的问题,其中一个关键的难点是确定真核生物的三个重要特征——细胞核、线粒体和内膜系统——是如何以及何时出现的。这个问题引发了两种主流的假说,分别是早期线粒体假说和晚期线粒体假说。早期线粒体假说认为,真核生物的形成需要大量的能量,而线粒体是能量的来源,因此线粒体是最先被古菌宿主获得的。晚期线粒体假说则认为,线粒体是通过宿主的吞噬功能进入细胞的,而吞噬功能需要内膜系统和细胞骨架的支持,因此线粒体是在宿主已经具备了真核特征之后才被获得的。这两种假说看似陷入了一个无法解决的循环论证,就像是“先有鸡还是先有蛋”的悖论一样。为了打破这个僵局,双方都提出了各自的理论和证据,试图证明自己的观点是正确的。
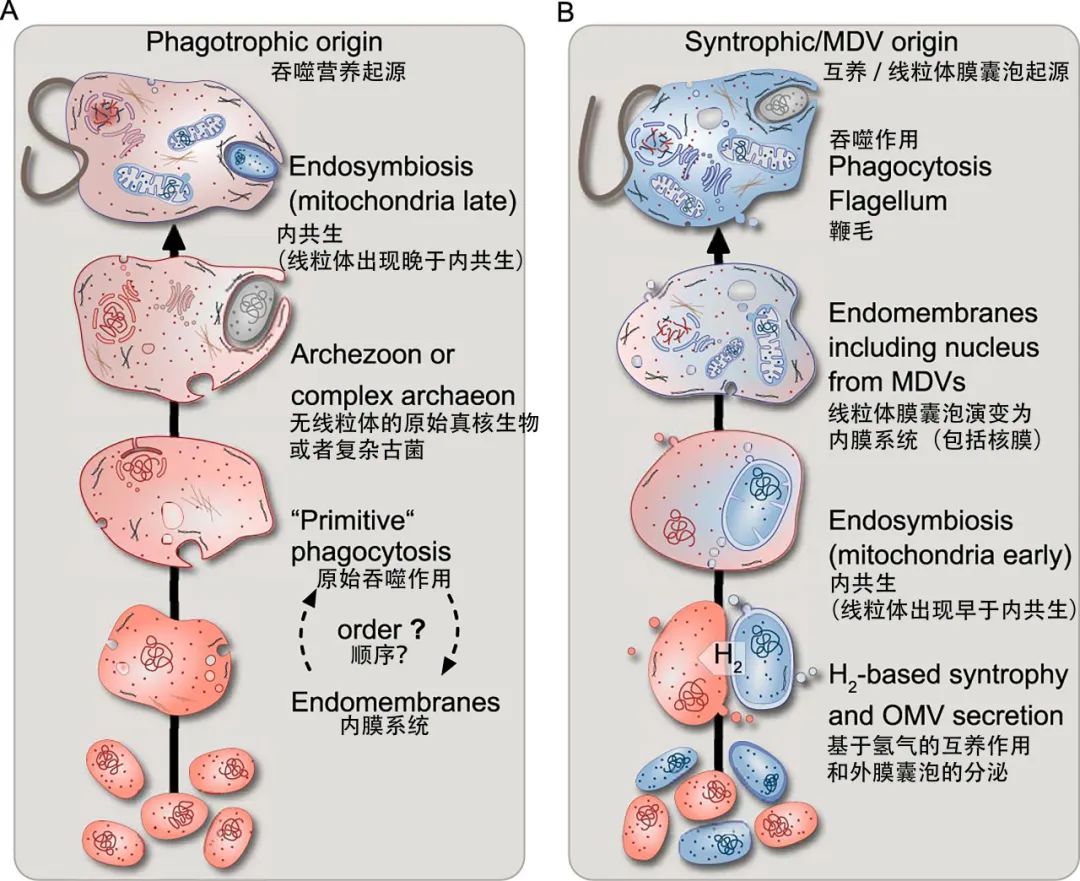 图七 晚期线粒体假说(左)和早期线粒体假说(右)的示意图[11]
图七 晚期线粒体假说(左)和早期线粒体假说(右)的示意图[11]
早期线粒体假说的代表人物之一是威廉·马丁(William Martin),他通过一系列的计算和推理,试图证明没有线粒体的情况下,吞噬功能是不可能存在的。他的论点是,古菌没有膜蛋白的回收机制,因此如果它们要吞噬其他细菌,就必须先消化掉被吞噬细菌的膜上的所有ATP合成酶,然后再重新合成它们。这个过程是非常耗能的,而且对于没有线粒体的原核生物来说,合成ATP合成酶本身就是最耗能的生理过程之一。马丁认为,如果吞噬宿主依靠呼吸作用获取能量,那么这个过程会导致超过400%的能量损失;如果它依靠发酵作用获取能量,那么它需要在一个细胞周期内吞噬掉相当于自己体重34-170倍的猎物。这些都是不现实的情况。马丁还指出,原核生物的复杂性受到了生物热力学的限制,即使是最简单的内膜系统,也需要消耗细胞一生所获得的能量的3/4,这样的细胞就没有足够的能量进行繁殖,也就无法生存下去。因此,马丁认为,吞噬宿主必须先有线粒体,才能有足够的能量支持吞噬功能和内膜系统的形成[11]。
晚期线粒体假说的支持者并没有放弃,他们也提出了一些有力的反驳。美国细胞生物学家马克·菲尔德(Mark Field)发现了一些与膜回收机制相关的SNARE结构相关蛋白,这些蛋白广泛存在于真核生物的基因组中,并可能是真核生物分化之前就已经出现的。这意味着,吞噬宿主可能已经具备了膜回收机制,只是在古菌的演化过程中丢失了[12]。这是一个有趣的发现,但是还不足以完全否定马丁的理论。更令人震惊的是一种名为Monocercomonoides exilis的单鞭毛虫的发现。这是一种没有线粒体的真核生物,但是却具有内膜系统,并且可以吞噬微小的食物颗粒。这似乎证明了真核生物的内膜系统和吞噬功能可以在没有线粒体的情况下存在。然而,这一发现也受到了一些质疑。有人认为,Monocercomonoides exilis之所以能够在进行低效率呼吸的同时具有内膜系统和吞噬功能,是因为它的体积非常小,所以它的能量需求也很低。此外,系统发育研究表明,Monocercomonoides exilis是单鞭毛虫中唯一没有线粒体的物种,这很可能是一次继发性的线粒体丢失事件,而不是真核生物的原始状态。
内膜系统起源模型
05
真核细胞的一个关键特征是内膜系统,它是由一系列结构和功能相互联系的膜性细胞器组成的,包括内质网、高尔基体、溶酶体、胞内体、分泌泡等。内膜系统不仅增加了细胞内膜的表面积,还实现了细胞质空间的分区,极大地提高了代谢反应的复杂度和效率。内膜系统对于真核生物的复杂化具有重要的演化意义。然而,内膜系统是如何起源的呢?这是真核发生过程中的一个难题。另一个难题是,真核细胞的细胞膜和内膜系统都是由酯型脂质组成的,而真核细胞的祖先——古菌细胞膜却是由醚型脂质组成的。这种脂质替换是何时、为什么发生的呢?
图九 真核细胞的内膜系统
图源:Wikipedia
关于这一个问题,人们提出了各种各样的假说。外膜囊泡模型曾是得到广泛承认的假说之一。该模型的提出同样基于一个吞噬宿主的存在。该宿主为了消化猎物外膜蛋白和排放废物会产生大量不同类型蛋白质和脂质组成的内膜囊泡,随着内膜消化特异性的逐渐增加,各种不同的内膜的组成逐渐稳定下来。形成了最早的细胞室区隔和原始内膜系统。除此之外,还有很多模型认为内质网等膜细胞器(甚至包括核被膜)是由细胞膜向内折叠或者凹陷产生的。但这些模型在解决脂质替换问题时都存在困难。2014年,威斯康星大学麦迪逊分校的实验生物学家大卫·鲍姆(David Baum)和他的堂兄伦敦大学学院细胞生物学家巴兹·鲍姆(Buzz Baum)一起提出一个非常精巧的假说——inside-out模型[13]。在该模型中,内共生是由α变形菌与嗜氢古菌日益密切的互利共生驱动的。在互利共生时期,嗜氢古菌为α变形菌提供小分子有机物作为养料,而α变形菌则回馈古菌宿主以ATP形式的能量和还原性的氢。由于界面处的相互作用,古菌细胞膜开始形成突起,这加强了两物种之间的物质能量交换效率,提供了选择优势。在选择压力作用下,突起部分逐渐增大并复杂化,并最终包围整个α变形菌。这个过程中,原本的突起颈部形成核孔复合物,最初的细胞质空间演化成细胞核室。同时,α变形菌也在不断形成和分泌甘油酯脂质,此时的细胞很可能具有同时具有酯醚两种膜。后来随着外界环境的变化,甘油酯型细胞膜逐渐替换了古菌原本的醚型细胞膜。最后,随着最外层突起的闭合,内部由突起导致的折叠的膜结构形成了最初的内膜系统。这一模型为真核发生过程中的多个难题提供了可能的解决方案,包括内共生发生、细胞核起源、内膜系统起源以及脂质替代问题等。一经提出便受到了广泛的赞许,但它同样仍需要更多的观察和实验证据来支持。
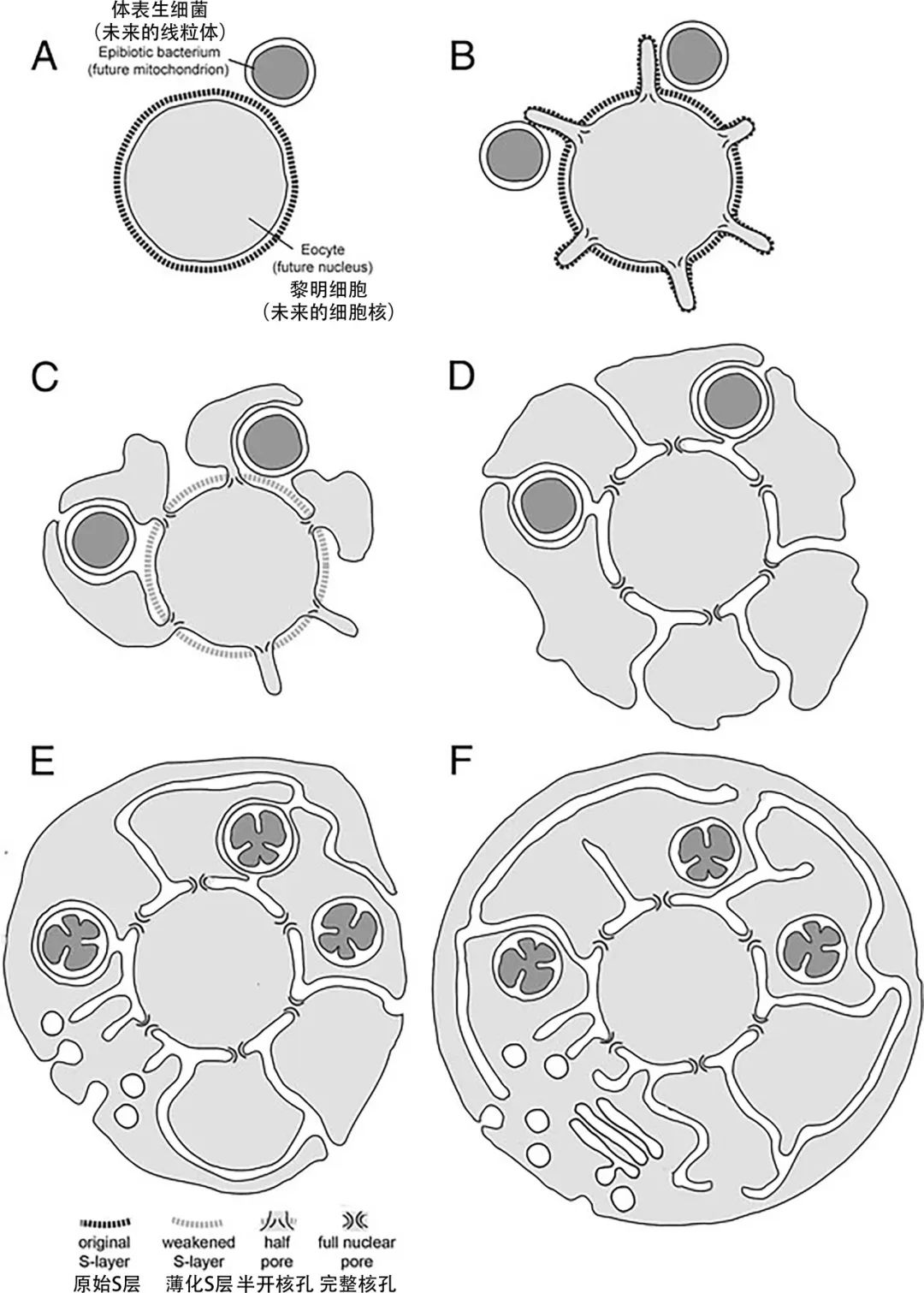
图十 鲍姆兄弟提出的Inside-out模型[13]
阿斯加德古菌照亮了漫漫前路
06
在地球生命演化之始,原核生物们微小的体型和单细胞的生活状态使得它们几乎不可能留下什么化石证据以供科学家们一探究竟。这场大论战中,几乎没有人敢宣布自己是最后的胜利者。我们是否永远无法揭开真核生物起源的秘密呢?不,阿斯加德古菌再一次照亮了人类探究真相的道路。最近,埃特玛等人利用先进的系统发育方法,基于阿斯加德古菌的基因组数据,重建了阿斯加德古菌和真核古菌祖先的特征,并推断了从原核生物到真核生物的演化过程[14]。他们发现,与其他阿斯加德古菌相比,真核的祖先古菌基因组中,与细胞骨架和膜运输相关的基因大量增加,并且与现代真核生物的同源基因高度相似。这表明,祖先古菌可能已经具备了膜变形和原始的膜运输能力。此外,他们还发现,虽然大多数阿斯加德古菌及其共同祖先都是嗜热的,但真核生物的祖先却是一种嗜温古菌,这支持了环境变化导致的膜脂质替换假说。这一假说认为,生物的醚型脂质在高温下更稳定,但在温和温度下反应活性较低,而酯型脂质则相反。因此,我们可以推测:古菌祖先都生活在海底热泉等高温环境中,所以它们都具有醚型脂质。后来,真核生物的祖先古菌适应了温和的环境,这使得它们的醚型脂质变得多余,甚至影响了它们的化学反应速率。于是,它们逐渐放弃了合成醚型脂质的能力,转而使用酯型脂质构建所有的膜结构,完成了这一重要的转变[15]。
图十一 冷冻电子断层扫描构建的人工培养阿斯加德古菌的细胞结构[16]
图源:ScienceDirect
总之,虽然埃特玛的的研究结果为我们以前所未有的精度描绘了从原核生物到真核生物的转变过程。为我们解开了许多生命多样性演化之初的未解之谜。然而,科学家从不会停下探索未知的脚步。例如,由于阿斯加德古菌生长于极端环境,直到2020年,日本科学家井町宽之(Hiroyuki Imachi)才第一次成功在实验室内培养出了阿斯加德古菌,这使得人类进行各种各样实验来观察生理生化过程[17]。深圳大学的李猛教授团队在我国南海发现了海姆达尔古菌的姊妹群——悟空古菌(Wukongarchaeota)。与海姆达尔古菌和它们的真核后裔不同,悟空古菌是一种自养古菌,提出了真核生物可能起源于“自养型阿斯加德古菌与发酵型细菌”的代谢共生模式[18]。上文提到的鲍姆兄弟也在开发新的实验方法修正和完善他们的理论模型。时至今日,真核生物的起源仍是地球生命史上最大的谜团之一,希望人类最终能给出这个谜团中所有问题的答案。
参考文献
1. Forterre, Patrick, and Herve Philippe. "The last universal common ancestor (LUCA), simple or complex?." The Biological Bulletin 196.3 (1999): 373-377. https://doi.org/10.2307/1542973
2. Hug, Laura Audrey. Examining deep level eukaryote phylogenies, molecular dating, and organellar adaptation. Library and Archives Canada= Bibliothèque et Archives Canada, Ottawa, 2008. https://doi.org/10.1016/0092-8674(86)90367-3
3. Gabaldón, Toni. "Relative timing of mitochondrial endosymbiosis and the “pre‐mitochondrial symbioses” hypothesis." IUBMB life 70.12 (2018): 1188-1196. https://doi.org/10.1002/iub.1950
4. Morell, V. (1997). Microbial Biology: Microbiology's Scarred Revolutionary. Science, 276, 699-702. https://doi.org/10.1126/science.276.5313.699
5. Watson, T. (2019). The trickster microbes that are shaking up the tree of life. Nature, 569(7756), 322-324. doi: https://doi.org/10.1038/d41586-019-01496-w
6. Lake, J. A., Henderson, E., Oakes, M. et al. (1984). Eocytes: a new ribosome structure indicates a kingdom with a close relationship to eukaryotes. Proceedings of the National Academy of Sciences, 81(12), 3786-3790. https://doi.org/10.1073/pnas.81.12.3786
7. Margulis L (1970). Origin of Eukaryotic Cells, New Haven, CT: Yale University Press.
8. Martin, W. F., Garg, S., Zimorski, V. (2015). Endosymbiotic theories for eukaryote origin. Philosophical Transactions of the Royal Society B: Biological Sciences 370, 20140330-20140330. http://doi.org/10.1098/rstb.2014.0330
9. Timmis, J. N., Ayliffe, M. A., Huang, C. Y. et al. (2004). Endosymbiotic gene transfer: organelle genomes forge eukaryotic chromosomes. Nature reviews genetics, 5(2), 123-135. https://doi.org/10.1038/nrg1271
10. Zaremba-Niedzwiedzka, K., Caceres, E., Saw, J. et al. Asgard archaea illuminate the origin of eukaryotic cellular complexity. Nature 541, 353–358 (2017). https://doi.org/10.1038/nature21031
11. Martin, W. F., Tielens, A. G., Mentel, M., Garg et al. (2017). The physiology of phagocytosis in the context of mitochondrial origin. Microbiology and Molecular Biology Reviews, 81(3), 10-1128. https://doi.org/10.1128/mmbr.00008-17
12. Koumandou, V. L., Dacks, J. B., Coulson, R. M. et al. (2007). Control systems for membrane fusion in the ancestral eukaryote; evolution of tethering complexes and SM proteins. BMC evolutionary biology, 7, 1-17. https://doi.org/10.1186/1471-2148-7-29
13. Baum, D.A., Baum, B. (2014). An inside-out origin for the eukaryotic cell. BMC Biology 12, 76. https://doi.org/10.1186/s12915-014-0076-2
14. Eme, L., Spang, A., Lombard, J. et al. (2017) Archaea and the origin of eukaryotes. Nat Rev Microbiol 15, 711–723. https://doi.org/10.1038/nrmicro.2017.133
15. Spang, A., Saw, J., Jørgensen, S. et al. (2015). Complex archaea that bridge the gap between prokaryotes and eukaryotes. Nature 521, 173–179. https://doi.org/10.1038/nature14447
16. Gross, M. (2023). Archaic ancestors. Current Biology, 33(10), R377-R379.
17. Imachi, H., Nobu, M. K., Nakahara, N., et al. (2020). Isolation of an archaeon at the prokaryote–eukaryote interface. Nature, 577(7791), 519-525. https://doi.org/10.1038/s41586-019-1916-6
18. Liu, Y., Makarova, K. S., Huang, W. C. et al. (2021). Expanded diversity of Asgard archaea and their relationships with eukaryotes. Nature, 593(7860), 553-557.










