【第五期EES】从发育偏差角度讨论我们是否需要一种新的演化理论
自上世纪初孟德尔的遗传理论被重新发现以来,演化生物学有了长足发展。1942年,Julian Huxley在其著作《The modern synthesis》中充分总结了群体遗传学理论和新达尔文主义思想,并正式提出了现代演化综论(MS)的概念[1],MS所代表的群体演化理论体系此后逐渐成为人们所熟知的经典演化理论。然而,不断有学者认为MS理论本身需要添加新的概念来解释演化。直到2007年,随着两篇文章的发表,“拓展的演化综论”(EES)这一概念的正式提出将此前零散的声音汇总[2, 3]。在前一篇文章中,Massimo Pigliucci基于多个角度讨论了在MS理论基础上建立EES的必要性,这种多中心模型被认为是广义的EES[2];而Gerd Müller的文章则从演化发育生物学(evo-devo)角度提出EES,因此狭义层面的EES特指MS与evo-devo的结合[3]。2010年出版的著作《Evolution, the Extended Synthesis》[4]从不同方向详细阐述了EES的观点与诉求。Evo-devo作为与广义EES话题之一的发育偏差(developmental bias)现象相对应的理论,诞生于以 Gerd Müller, Günter Wagner, Sean Carroll, Eric Davidson为代表的演化学家的工作中。

创建 evo-devo 学科的演化学家们
左起:Gerd B. Müller(1953~),Günter P. Wagner(1954~),Sean B.Carroll(1960~),Eric H. Davidson (1937–2015)
这里首先给出对发育偏差现象的定义。不同物种存在广泛的形态差异,但并不是任何表型都会出现,例如一些动物能够长出翅膀、贝壳或蹄子,但不允许半人马这样的动物出现。这种抑制了个体形态朝着更丰富的可能方向演化的现象叫发育偏差(developmental bias)[5]。例如,自然界有3000多种蜈蚣,但它们的腿的数量都是奇数对[6]。再者,植物开花时的花瓣数目分布并非随机,而是经常呈现出3,5,8,13等斐波那契数量特征。这些现象向我们清晰地展示了表型空间非随机的各向异性。

发育偏差的实例。左:几乎所有种类的蜈蚣都有奇数对腿右:许多花的瓣数都符合斐波那契数列(每一项等于前两项之和,如5=3+2,8=5+3,13+8+5,以此类推。图片来源于网络)
三胚层发育模式是后生动物(约等于多细胞动物)最普遍且保守的发育偏差模式。发育生物学的重要开创者之一,著名的“贝尔法则”提出者,von Baer研究鸡的胚胎发育时发现:不同的组织器官都来自于原肠胚阶段的三个胚层。事实上,除了海绵、水母等相对原始物种采用二胚层发育模式之外,脊椎动物、昆虫、海星、章鱼等形形色色的复杂动物的器官都来源于它们原肠胚阶段的三个胚层,它决定了绝大部分后生动物都是以两侧对称的方式来发育。因此他在对比了许多动物的发育过程后提出了贝尔法则,简单概括就是相对早期的胚胎发育模式代表越广泛门类的共同特征,而在发育相对后期阶段出现的特征代表越特化的物种间差异[7]。“越早期的胚胎长得越像”这种观点代表了19世纪的人们对于发育偏差这一现象的最初认知。接下来,我们将看到对发育偏差现象的研究为何深度改变了我们对于演化的理解。
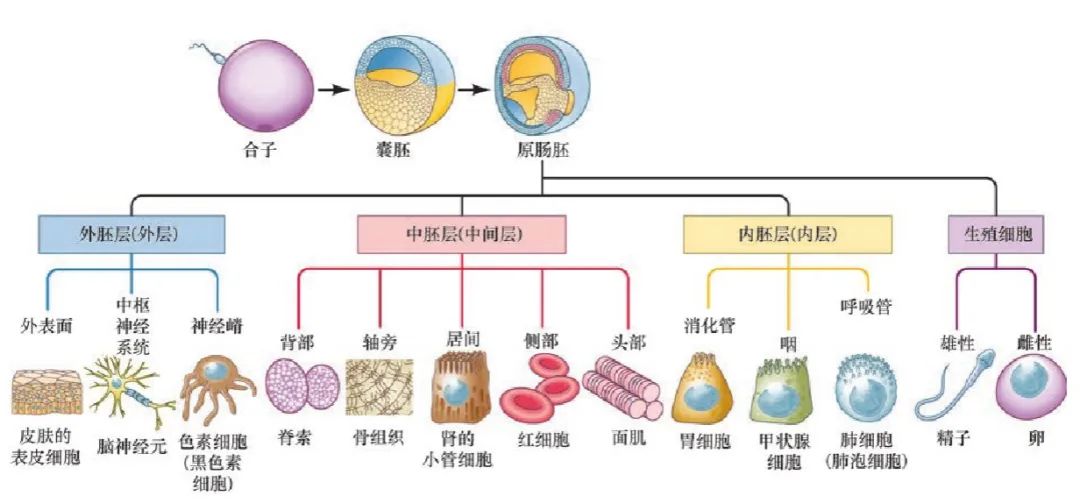
原肠胚形成胚胎的三个不同胚层。每个胚层都产生无数的分化细胞类型(这里只显示了少数有代表性的细胞类型)和不同的器官系统。生殖细胞(精子和卵子的前体)在早期发育中就被搁置起来,不源于任何一个特定胚层。
01. 发育限制:经典演化理论视角下的发育偏差
在传统演化领域看来,这类现象限制了生物演化出更多可能的形态,因此发育偏差最开始被定义为发育限制(developmental constrain)[8]。它可能诞生于并非适应性的,而是“偶然的”或 “随机的”机制。比如手性氨基酸,据推测,在生命进化的早期阶段,氨基酸的左右旋在生物中的比例大致相同。通过某种随机现象,左旋氨基酸恰好被扩增了更多而变得更加普遍,那些碰巧能最有效地利用这种现象的生物体就会有明显的优势。
这里需要介绍一个重要的概念,body plan。某些高度保守的发育限制被认为是为了确保某些个体生存所必需的结构正确发育而产生的。Body plan是一组在形态发育过程中某个阶段广泛保守的一系列特征,共享同一套body plan特征的物种会被划归到同一个门、亚门或超门之中,其保守性背后往往代表着至关重要的发育过程[9]。由于与其他发育过程的大量相互作用,三胚层模式等某些中枢发育过程的中断将产生广泛影响,从而威胁个体生存。因此,为了确保适当的发育,一些过程的变化能力受到限制,而这种限制通常通过稳定选择来维持[10]。
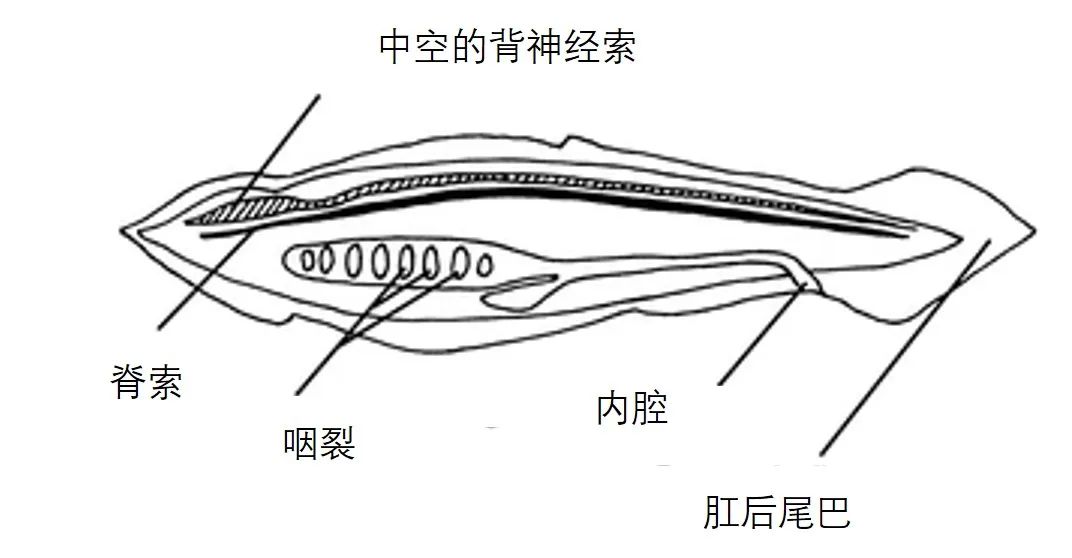
脊索动物body plan由脊索、咽裂、空心背神经索、内腔和肛后尾巴等特征组成[11]
因此,在传统演化学家看来,发育限制概念已被充分讨论,未来关于发育限制的工作的最重要目标之一可能是分析它产生的分子机制。Maynard Smith(1998)强调了这一点,“如果不能具体说明限制是什么或为什么存在,仅仅使用‘发育限制’一词并没有多大帮助”[12]。他们承认“发育限制”这一概念是演化理论大厦的一层楼,但不像“自然选择”、现代遗传学等理念组成了它的地基。
02. 演化潜力:EES视角下的发育偏差
EES则指出,传统演化论没有把发育偏差看作与自然选择同等重要的理论概念是因为他们没发现发育偏差能带来演化潜力解释[11]。演化潜力(evolvability)是一个贯穿了演化生物学研究的核心概念,它是当代演化理论最基本的假设之一:复杂的生物可以产生于对随机遗传变异的选择,而无需诉诸任何超自然力量(神创论)。Rupert Riedl最早意识到,发育偏差不仅带来演化限制,也会带来演化潜力。
上世纪70年代末,Riedl发现不同的性状以明显不同的速率演化,与body plan相关的特征演化得特别慢。为了解释这一现象,Riedl引入了两个概念:负担(burden)和演化潜力[13]。如果一个性状受许多其他性状依赖,而且它的功能非常重要,那么这个性状的负担就很大。具有高负担的性状演化得非常缓慢。然而这种负担对另一些特征的演化来说则是产生演化潜力的基础,例如脊椎动物的脊椎在继承其祖先的脊索结构基础上出现,硬骨鱼获得硬骨发育的能力要在继承其祖先软骨发育的基础上实现。新特征依赖于已经存在的特征,因此增加了旧特征的负担数量或等级。发育偏差的这种层级性(hierarchy )特征表明,理解那些高负担的性状如body plan如何起源对于研究复杂生物演化至关重要。
Riedl阐释了发育偏差的层级性,他的学生Gerd Müller和Günter Wagner又在此基础上进一步指出发育偏差来自于不连续的演化过程。过去相当长时间里,形态演化被理解为一个连续缓慢变化的过程。主流演化学者们曾普遍认为,所谓新性状的产生并不是一个从无到有的过程,它只是原有生理结构在适应新环境过程中演变出了新的功能[14]。但上世纪90年代初,Müller和Wagner于指出,新性状是一种以前不存在的结构;因此,它的起源问题不能从功能和适应性的角度来解决。”evo-devo“这一概念正是在讨论新性状起源本质的基础上被他们首次提了出来[15]。接下来,我们将看到某些被称为演化创新的不连续演化事件在物种形成和分化中扮演什么样的关键作用,及其内在的分子机制。
03. 基因调控网络对发育偏差层级性的解释
Rupert Riedl在很大程度上将body plan的概念从形而上学的过去带到目前evo-devo研究的中心位置,他提出的表型层面关于负担、可演化性和body plan的大部分概念被当前的基因调控网络(GRN)理论在分子层面所解释。自80年代以来,随着大量转录因子和信号分子的发现,人们对发育特征有了更深刻的认知。转录因子能在细胞核中通过结合特定DNA序列来调控附近基因特异性表达,它们在细胞分化的过程扮演上游调控功能。信号分子蛋白则提供了诱导细胞分化的外部信号,在结合细胞膜受体通过一系列细胞回路激活转录因子的调控功能。因此,转录因子和信号分子的基因被称为动物发育的“遗传工具盒”(genetic toolkit)[16]。它们作为蛋白参与控制细胞分化过程;同时作为基因,它们发挥特定功能也需要在其他基因的调控下特异性地表达出来才能实现。这种彼此相连的调控关系构成了庞大的基因调控网络(GRN)。认识到发育调控的重要性是evo-devo的核心贡献。
Eric Davidson等人在上世纪70年代提出了GRN的概念,解释了发育偏差的保守性和演化潜力,该理论成为了evo-devo的核心[17]。他将GRN拆分成4部分结构,依次为:(1)由上游转录因子间的调控关系构成的内核;(2)外部信号分子作为驱动该网络的插件;(3)被转录因子结合并激活附近基因特异性表达的非编码元件(主要是增强子);(4)被(1)和(3)特异性结合而激活表达并执行下游具体功能的终端基因。Eric Davidson敏锐地指出,表型层面发育偏差的限制性本质上来自于GRN内核的保守性。GRN内核一旦被门或门以上级别的共同祖先建立,就很难被更改,于是我们就会看到门以上结构内不同物种间广泛保守的body plan。下游调控关系的变化被认为带来了纲以下不同演化级别的形态差异。可以想象,这会为我们对于演化的认知赋予一种更深入的表述方式:从过去基于body plan表型特征定义一个门,转化为未来我们可以通过一组高度保守的调控网络集合来定义一个门(也包括超门、亚门、纲等)。Evo-devo理论将调控网络的不同层级与不同保守程度的表型相对应,构建的是一种自上而下的层级性演化逻辑:动物演化在继承保守的GRN内核的同时不断建立更多不同的下游调控关系,这使得发育的复杂性得以不断累积,并进一步产生了适应更广泛环境的演化可能性。
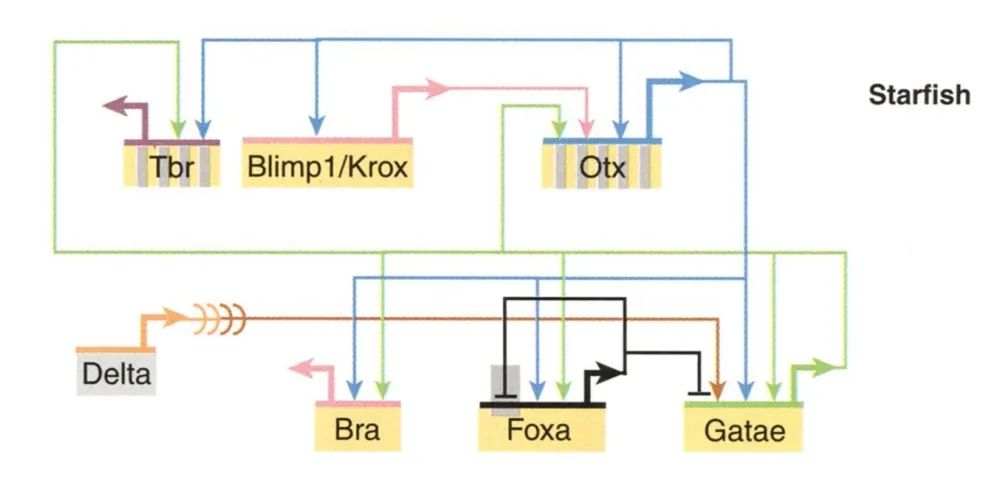
海星的中胚层分化的基因调控网络内核
04. 宏观演化过程中的深度同源性与演化创新
在漫长的演化研究历史中,不同门类物种间的器官同源性一直是人们想弄清楚的关键问题,例如果蝇的复眼和脊椎动物的单眼究竟来源于共同祖先还是独立起源。这类问题很难从形态学层面得到答案,但evo-devo通过GRN同源性角度对此给出了有力的解释。
一个著名的例子来自最早发现的一批发育调控基因,Hox基因簇。果蝇Hox基因簇共有8个基因,它们在基因组中彼此相邻,并按照在基因组中的排列顺序依次在从头到尾的不同体节中表达,这被称为Hox基因的共线性表达[18]。除果蝇外,脊椎动物经历两次全基因组复制事件而获得的4个Hox基因簇同样表现出随体节发育共线性表达的特征,这反映了该模式建立于两侧对称动物的共同祖先,哪怕脊椎动物和昆虫的体节形态现已完全不同[19]。Evo-devo研究还发现,果蝇和脊椎动物共享眼睛发育[20]和心脏发育[21]的GRN核心,只是GRN下游调控关系的差异导致它们的形态结构迥然不同。这种在发育调控网络上游高度保守的现象被称为深度同源性(Deep Homology)[22]。三胚层模式的建立对复杂后生动物的个体发育和系统发生过程都至关重要。
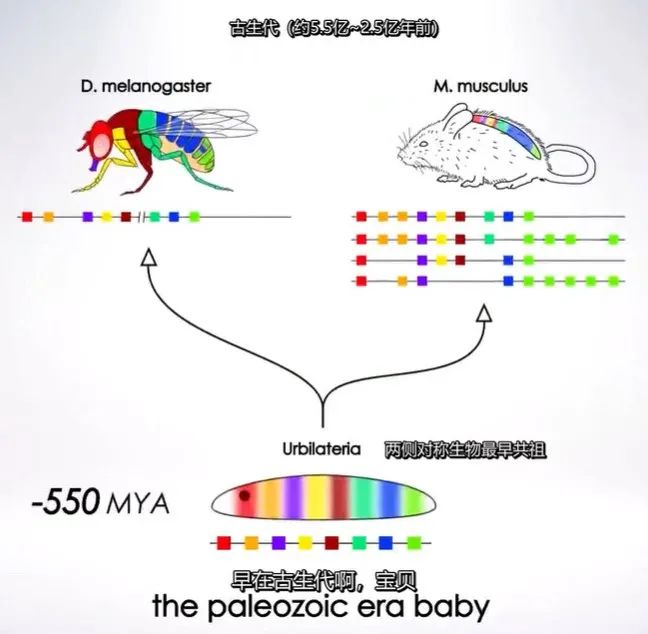
Hox基因簇在节肢动物和脊椎动物中的基因组顺序与表达顺序的保守共线性(图片来源:https://www.bilibili.com/video/BV1r4411G7D3)
然而,并非所有现生动物的器官都能在更古老类群中找到同源器官。也就是说,某些保守的器官发生或细胞分化模式的出现是发生在寒武纪之后的演化创新。例如两栖类、爬行类、鸟类、哺乳类等四足动物的四肢整体上与鱼鳍是同源器官,但四足动物的爪子却无法在鱼鳍中找到同源结构。从形态层面上,人们猜测,四足动物的爪状四肢远端结构应该来自一次全新的演化创新事件[23],而evo-devo的证据有力地支持了这一假说。在有颌动物中,发育信号分子SHH在肢芽处激活了附近细胞内的Hox基因簇功能[24],这导致鱼鳍和脊椎动物四近端(上臂)发育时,Hox基因起初同样按照其在基因组的顺序优先表达Hoxd1一侧的基因(共线性)。而到了四足动物的四肢远端发育时,又激活了优先表达Hoxd13一侧基因的新模式(反共线性)[25]。这两次激活分别来自HoxD基因簇两侧的不同调控元件,因此它们使得Hox基因两次表达顺序截然相反。HoxD簇的第一段激活继承自古代鱼类祖先,而第二段激活则是来自四足动物“登陆”演化过程中诞生的新调控元件,所以爪组织无法在鱼类中找到同源器官。演化的不连续性表明,编码手足等新特征的调控机制需要在四肢等旧特征的基础上建立,但它并不是由编码旧特征的调控方式直接转变出来的。
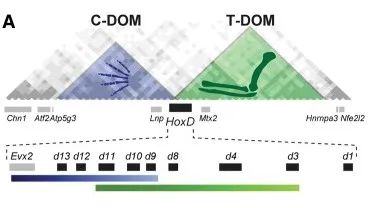
四足动物HoxD簇两侧各有一个独立的调控簇,先后调控上肢(绿色)和爪/手(蓝色)的发育,前者继承自有颌动物共同祖先,后者起源于四足动物登陆时的演化创新。蛇类则因上游ZRS失活而失去该发育能力。
Sean Carroll在对evo-devo的规律进行系统性总结后进一步指出,这种调控关系的累积并非主要由基因突变与新基因的产生所致,而是来自于基因组非编码区的演化,这一点与此前MS默认的结论截然相反[22]。例如关键的转录因子或信号分子基因往往在海绵、水母等较为原始物种中都能找到同源基因,但在复杂动物中,它们在更多胚胎区域特异性表达,由此参与多个不同的发育过程。比较基因组学发现,这类基因上游往往分布着一个巨大的基因沙漠,其中包含多个高度保守的非编码调控元件,该结构被称为基因组调控模块(GRB)[26]。不同的调控元件在不同发育过程中激活关键发育基因表达,这些基因的功能因此在进化过程中变得更加多样化(例如前文提到的Hox基因簇既参与体节发育也参与脊椎动物四肢发育过程)这导致各种动物整体上都朝着生理结构越来越复杂的方向进化。
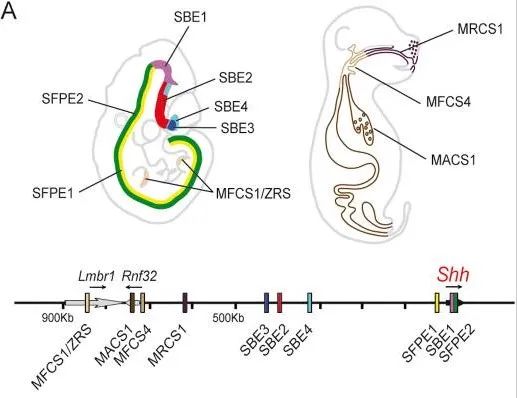
信号分子基因Shh上游有多个高度保守的调控元件组成了一个GRB,它们分别在不同胚胎区域激活Shh表达,其中ZRS增强子调控Shh在肢芽特异性表达。
05. evo-devo丰富了生命演化研究的内涵
我们都知道,想彻底解释复杂性状的形成,既应考虑个体发育中的“近因”,也应考虑其祖先演化过程中的“远因”。19世纪的科学家们也曾热衷于讨论它们之间的关系,但基于形态学层面的表述过于粗糙导致代表性的重演理论走向衰败。此后发育学家们仅研究少数代表性物种的具体发育机制,而放弃了演化的框架;同时演化学家们仅讨论群体水平的表型变异,而对基因型如何导致表型形成缺乏探索[16]。直到上世纪70年代末,Stephen Gould在其著作《Ontogeny and Phylogeny》[27]中重新整理了前人工作,并第一次认真地尝试将个体发育与系统发生研究相结合。之后的历史告诉我们,Gould的伟大尝试引导了巨大的成功。Hox基因的发现最初只是源于对“同源异型”这一遗传学现象的研究。Edward B. Lewis发现Hox基因簇共线性调控体节发育,进一步将其延展到了发育生物学领域,并将长期停滞的发育生物学送上了迅速发展的快车道。而该调控模式的深度同源性现象又将这样的个体发育问题延展到决定系统发生的演化领域。过去人们可能难以想象,这样三门有着截然不同的起源与传承的学科竟然在一组Hox基因的牵引下走到了一起。回顾历史,我们会找到这样一条无比清晰的演化理论发展脉络:遗传学与演化论的结合诞生了MS,而发育生物学的加盟导致EES被提了出来。

跨时代的EES先驱,间断平衡理论提出者,Stephen Jay Gould(1941~2002),及其代表性著作《ONTOGENY AND PHYLOGENY》封面
回顾历史的同时,我们不禁要思考,是什么导致了长期以来,发育学家和演化学家们普遍对互相合作缺乏兴趣?这是因为80年代以前,人们很难想象,在生命之树上相隔甚远的不同门类的动物居然是以同一套发育基因集合,同一套基本的发育调控网络,来指导如此繁复而迥异的形态特征的形成。这导致人们一直以来都默认不同门类的动物应该逐渐演化出了截然不同的发育模式,对于不是十分近缘的物种来说,它们的发育基因一定相差甚远。因此过去长达百余年,人们曾难以理解为什么不同门类复杂动物各自的直系祖先,都集中地出现于寒武纪早期的约2000万~4000万年前的狭窄窗口内。如上文所述,evo-devo根据发育调控的深度同源性,以前所未有的程度地加强了演化论的“共同祖先”假设,它表明所有现生的两侧对称动物动物门,本质上诞生于同一次演化创新事件。两侧对称动物最晚共同祖先(Urbilateria)的不同分支后代在继承其基本发育特征的同时添加了不同的末端发育机制。而在数亿年的漫长演化过程中,越来越多调控模式的依次累加,使得某些建立于早寒武纪的末端发育机制被逐渐固定为高度保守的早期发育机制,对应不同门的body plan。因此一个庞大的物种门类是漫长演化的结果,并非门级别的祖先种群诞生于寒武纪早期就决定一个独立门类出现。也就是说,寒武纪物种大爆发不代表至少有数十次独立的重大演化事件恰好发生在同一个很短的窗口内。evo-devo的解释有力地驳斥了反演化论者口中所谓的“最重要证据”。
Evo-devo不仅加深了人们对演化的认知,在研究方法上也提供了创新。Evo-devo则指导人们在现生类群中寻找处于复杂性状起源不同阶段的物种,通过比较它们的发育过程及其背后的基因组调控模式差异,来弄清演化历程中的重大演化创新事件是如何发生的。由这些研究所确定的具体基因组变异,则完全可以用基因编辑手段,在现有的模式动物中验证功能[20, 28, 29]。过去,我们基于化石证据对性状起源问题的研究往往缺乏可验证的手段,但evo-devo则能弥补这方面的缺陷,进一步增加了演化研究成果的可靠性。
我们可以展望,evo-devo未来也许能从不同视角对一些曾被充分研究过的传统生物学问题给出新的解释。例如”基因序列→蛋白序列→蛋白结构→蛋白功能“,这一叙事逻辑使得对基因突变的选择压力成为演化研究中的主要问题之一。我们知道,生态位的空缺会使得更多非同义基因突变被保留下来,以适应新环境,此时表现出了加速演化的正选择效应。然而,evo-devo视角可能带来这样的图景:演化加速可能不仅来源于生态位空缺等外部环境变化,也可能来自演化创新事件为某个生物类群带来新细胞类型。新细胞类型的出现会调控某些下游基因获得全新的表达模式,这些基因也可能有更多的非同义突变被容忍,以帮助新细胞类型的具体生理功能得到固定。未来也许有更多证据表明,演化的加速可能既受环境外因影响,也有产生演化潜力的内因参与。
06. evo-devo能否为演化生物学带来理论创新?
如前文所述,近三十余年来对产生发育偏差现象背后的分子调控机制的一系列深入研究对演化生物学的影响是深远的。站在今天,evo-devo的一系列成果使得我们承认过去在”演化的不连续性“和”基因组非编码区的功能“等诸多问题上存在认知偏差。如今的evo-devo既不是虚无的抽象概念,也不是发育生物学和演化生物学的简单拼凑,而是和它们一样,是有具体问题与具体研究方法的有血有肉的学科。Evo-devo主要致力于解答某个动物门类的共同祖先经历了哪些关键基因组变异导致其建立了编码全新细胞类型或器官的调控模式,并为此后长达亿年以上的无数适应性演化过程产生不可忽视的演化潜力。但是,这是否意味着evo-devo会为演化生物学带来理论创新仍是一个值得探讨的问题。争论双方的焦点在于evo-devo的核心概念——“演化潜力”,是否能被新达尔文主义的理论框架所容纳。
反对者的主要理由是“演化潜力”的提出并没有破坏新达尔文主义的基本逻辑,即演化是一个基于变异和选择(加上漂变)的变化过程。基因组调控的层级性使得我们对遗传和发育获得了结构性认知,意识到某些微小遗传差异也能带来巨大表型效应。但是,在这批人看来,这只是对遗传变异的结构和形成某种表型背后的发育机制有了更深的理解;因此,evo-devo与新达尔文体系仍处于同一框架之中,它只是自然选择理论在发育领域的延续而已[6]。
理论创新的支持者则指出evo-devo也会带来新达尔文主义之外的内容,即进化的方向性。演化潜力需要在无数具体适应性演化过程累加的基础上得以实现。因此,只有当时间被拉到数千万至上亿年的尺度,“保守发育特征的依次累积使生物性状变得越来越复杂”这一趋势才缓慢显现,并由此定义出进化的宏观方向。而适应性演化的逻辑本身不会导出形态演化过程存在某种固有的方向性,它只能将具体性状的变化解释为对具体所处环境的适应。因此Gould认为生命系统中的复杂性累积不是自然选择的产物;有机体通过无数次具体的适应性演化,“像醉汉一样晃晃悠悠地漫步”到更复杂的状态中[30]。Wagner将这种复杂性状缓慢累积的趋势命名为演化潜力的进化(Evolution of Evolvability),并认为它与适应性演化共同参与了不同尺度的演化过程[31]。
150年前,人们发现“热不能自发从低温传导至高温”现象既不违背能量守恒也不能被其所解释,于是就提出了熵增定律并在热力学理论中将其置于与前者同等重要的位置。同理,我们并不需要找到一个使自然选择彻底失效的演化案例,而是发现仅依靠自然选择理论无法有效解释某些演化趋势就足以说明有必要进行理论创新。具体来说,当前有一个确定的争论议题,就是用演化潜力对”生物复杂性的缓慢累加“的解释是否被包含在新达尔文主义的逻辑之中。未来我们对它的更深度讨论将决定自然选择理论的边界会继续拓展还是有必要提出新的基本原理。总之,对于evo-devo这样一个目前只有30岁的年轻学科而言,我们今天就判定它将会为演化理论整体带来的无论是“机制创新”还是“理论创新”,都为时尚早。
参考文献
[1]HUXLEY J. Evolution. The modern synthesis [J]. Evolution The Modern Synthesis, 1942.
[2]PIGLIUCCI M. Do we need an extended evolutionary synthesis? [J]. Evolution, 2007, 61(12): 2743-9.
[3]MüLLER G B. Evo-devo: extending the evolutionary synthesis [J]. Nat Rev Genet, 2007, 8(12): 943-9.
[4]PIGLIUCCI M, MULLER G B. Evolution–the extended synthesis [J]. 2010.
[5]ARTHUR W. The effect of development on the direction of evolution: toward a twenty-first century consensus [J]. Evol Dev, 2004, 6(4): 282-8.
[6]MINELLI A. Evolutionary developmental biology does not offer a significant challenge to the neo-Darwinian paradigm [J]. Contemporary debates in philosophy of biology, 2010: 213-26.
[7]BARRESI M J F, GILBERT S F. Developmental Biology [M]. Oxford University Press, 2020.
[8]SMITH J M, BURIAN R, KAUFFMAN S, et al. Developmental constraints and evolution: a perspective from the Mountain Lake conference on development and evolution [J]. The Quarterly Review of Biology, 1985, 60(3): 265-87.
[9]VALENTINE J W. On the Origin of Phyla [M]. University of Chicago Press, 2004.
[10]HALL B K. Evolutionary developmental biology [M]. Springer Science & Business Media, 2012.
[11]WILLMORE K E. The body plan concept and its centrality in evo-devo [J]. Evolution: Education and Outreach, 2012, 5: 219-30.
[12]SMITH J M, SMITH J. Shaping Life: Genes, Embryos, and Evolution [M]. Yale University Press, 1999.
[13]RIEDL R. A systems-analytical approach to macro-evolutionary phenomena [J]. The Quarterly Review of Biology, 1977, 52(4): 351-70.
[14]BRIGANDT I. A Theory of Conceptual Advance: Explaining Conceptual Change in Evolutionary, Molecular, and Evolutionary Developmental Biology [M]. 2006.
[15]MULLER G B, WAGNER G P. Novelty in evolution: restructuring the concept [J]. Annual review of ecology and systematics, 1991, 22(1): 229-56.
[16]CARROL S B. Endless Forms Most Beautiful: The New Science of Evo Devo and the Making of the Animal Kingdom [M]. Phoenix, 2007.
[17]DAVIDSON E H, ERWIN D H. Gene regulatory networks and the evolution of animal body plans [J]. Science, 2006, 311(5762): 796-800.
[18]LEWIS E B. A gene complex controlling segmentation in Drosophila [J]. Nature, 1978, 276(5688): 565-70.
[19]BONCINELLI E, SOMMA R, ACAMPORA D, et al. Organization of human homeobox genes [J]. Hum Reprod, 1988, 3(7): 880-6.
[20]HALDER G, CALLAERTS P, GEHRING W J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila [J]. Science, 1995, 267(5205): 1788-92.
[21]REIM I, MOHLER J P, FRASCH M. Tbx20-related genes, mid and H15, are required for tinman expression, proper patterning, and normal differentiation of cardioblasts in Drosophila [J]. Mech Dev, 2005, 122(9): 1056-69.
[22]CARROLL S B. Evo-devo and an expanding evolutionary synthesis: a genetic theory of morphological evolution [J]. Cell, 2008, 134(1): 25-36.
[23]SHUBIN N, TABIN C, CARROLL S. Deep homology and the origins of evolutionary novelty [J]. Nature, 2009, 457(7231): 818-23.
[24]SHETH R, GRéGOIRE D, DUMOUCHEL A, et al. Decoupling the function of Hox and Shh in developing limb reveals multiple inputs of Hox genes on limb growth [J]. Development, 2013, 140(10): 2130-8.
[25]ANDREY G, MONTAVON T, MASCREZ B, et al. A switch between topological domains underlies HoxD genes collinearity in mouse limbs [J]. Science, 2013, 340(6137): 1234167.
[26]IRIMIA M, MAESO I, ROY S W, et al. Ancient cis-regulatory constraints and the evolution of genome architecture [J]. Trends Genet, 2013, 29(9): 521-8.
[27]GOULD S J. Ontogeny and phylogeny [M]. Harvard University Press, 1985.
[28]KVON E Z, KAMNEVA O K, MELO U S, et al. Progressive Loss of Function in a Limb Enhancer during Snake Evolution [J]. Cell, 2016, 167(3): 633-42.e11.
[29]BI X, WANG K, YANG L, et al. Tracing the genetic footprints of vertebrate landing in non-teleost ray-finned fishes [J]. Cell, 2021, 184(5): 1377-91.e14.
[30]GOULD S J. Full house [M]. Harvard University Press, 2011.
[31]DRAGHI J, WAGNER G P. EVOLUTION OF EVOLVABILITY IN A DEVELOPMENTAL MODEL [J]. Evolution, 2008, 62(2): 301-15.










