驱动不同物种突变率差异的隐秘力量
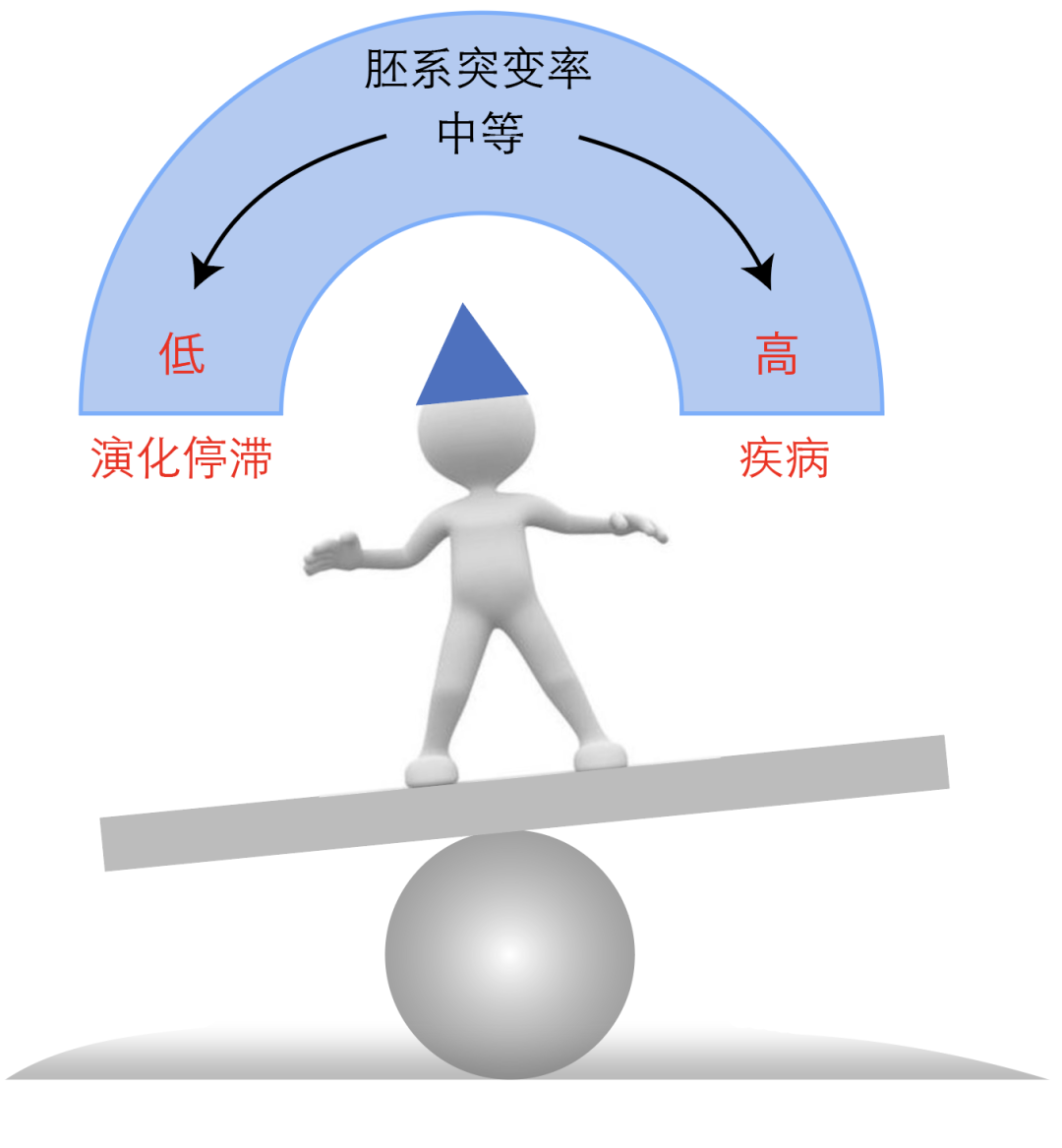
改变种群基因频率的力量是生物演化背后的驱动机制。有四种“演化力量”可以引起种群等位基因频率发生变化,包括突变、基因流、遗传漂变和自然选择。突变会导致生物基因组中核苷酸序列发生变化并产生新的基因型,为其它演化力量发挥作用提供了最初的原材料--遗传变异。因此,探究突变如何发生是演化生物学的核心问题之一。
张国捷团队 供图
早在1937年,作为遗传学之父摩尔根的学生,美国遗传学家阿尔弗雷德·斯特蒂文特(Alfred Sturtevant)就已经注意到大多数具有明显表型效应的突变都是有害的,并开始推测为什么突变率没有进化到零1。

美国遗传学家阿尔弗雷德·斯特蒂文特(Alfred Sturtevant,1891-1970)
他的著名结论是:“基因的本质不允许这样的减少”,即突变是不可避免的。而如今我们已经知道这是由于DNA复制错误和DNA损伤引起的复制不保真,此外在演化水平上,若物种停止变异,那就不能适应新的环境从而会被自然选择所淘汰。同时,斯特蒂文特基于对果蝇的研究观察发现不同物种之间,如黑腹果蝇和funebris果蝇,以及不同品系的果蝇之间突变率存在差异,而这背后最终的引发因素便是自然选择。直到今天,尽管许多学者提出了一些假说来解释突变率变化的机制,包括基因组内在特征和外在环境因素的变化,但突变率在演化过程中发生改变的根本原因仍然存在争议2。
DNA突变和细胞突变类型
DNA作为遗传信息存储的载体,在细胞之间进行传递的过程中会自发产生一些新的变异。这主要是由于两种分子机制产生:未受损DNA在复制过程中碱基错误结合,以及未得到正确修复的DNA损伤累积。而其它一些内在或外在因素,如基因组特征,内源性诱变剂,暴露的环境等最终作用在这上述两种机制上产生突变。在有性繁殖的物种中,影响进化的突变只有发生在生殖细胞中,这些突变才能遗传给后代,因此也称为生殖细胞的新生突变(胚系突变)。而身体其它部位的突变称之为体细胞突变。
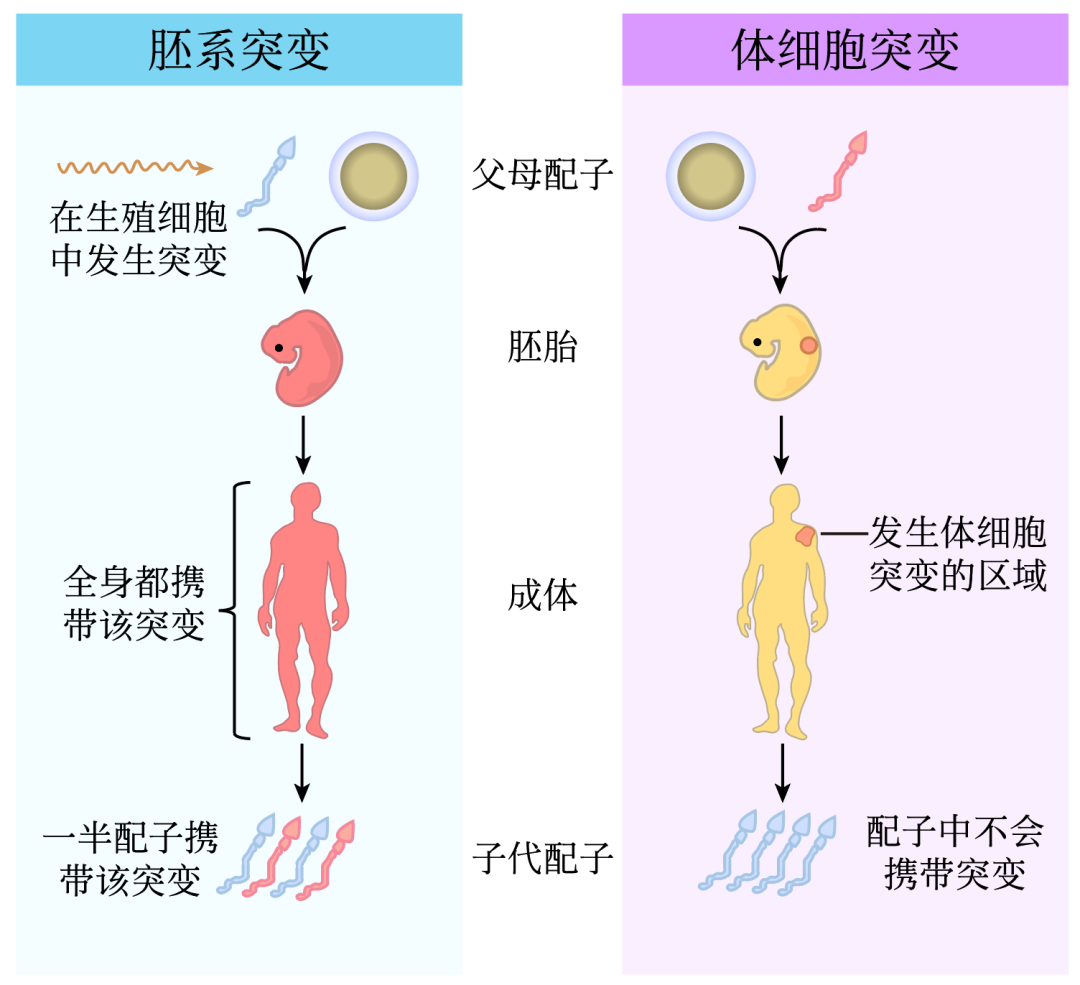
图2:胚系突变与体细胞突变的差异
原则上,体细胞突变率应与胚系突变率相一致。然而,与生殖细胞突变不同的是,体细胞突变对于维持遗传多样性并不是必需的,因此其突变率至少在原则上可以趋近于零。近年来,利用家系全基因组测序方法去寻找在子代中完全与父母都不相同的变异类型,促进了对人类新发突变的大规模检测和研究。然而,检测胚系突变和估算突变率研究方法的差异使得直接比较不同物种的新生突变速率变得困难。例如,即使使用相同的家系样品,不同的研究组采用不同的分析方法可以产生相差2倍的估值差异3。技术上引发的误差极大的限制了人们对不同物种新生突变速率变化规律的认知。
关于不同物种突变率差异的假说
目前针对不同物种突变率存在差异的原因主要有四种假说。
世代时间假说:该假说提出世代较短的群体其突变速率更快,这是因为它们在单位时间内经历了更多轮生殖细胞分裂。而更多次的生殖细胞分裂意味着额外的DNA合成和由于DNA复制错误引起的突变机率增高。例如在哺乳动物和鸟类中,由于生殖细胞在雄性和雌性之间存在显著的分裂次数差异,从而导致雄性突变率显著高于雌性4。
代谢速率假说:该假说认为代谢率较高的群体会产生更多的自由基,从而导致更多的DNA损伤和更高的突变率。例如恒温脊椎动物相对于变温动物具有更高的代谢速率和更快的mtDNA突变速率5。但该假说也存在例外,比如尽管鸟类的代谢速率更快,但它们mtDNA进化得比哺乳动物更慢。
DNA修复假说:该假说认为在DNA修复系统更好的群体中,更多的突变会在种群传播前被纠正,从而导致遗传变异原材料的减少以及通过遗传漂变和选择固定新突变的可能性。
不同的选择压力假说:突变速率的变化也可能是不同选择的结果。该理论指出,许多“中性”突变实际上是略微有害的,以至于它们的进化与种群规模密切相关6。对于那些选择系数绝对值<1/(4Ne)的突变,漂变要胜过纯化选择。因此,在较小的种群中,只有较少的轻微有害突变才会被暴露出来,并通过负选择删除。最终的结果是在较小的种群中演化速率加快,因为更多轻微有害的突变被保留。
脊椎动物生殖细胞突变速率的演化
2023年3月1日,Nature在线发表了浙江大学生命演化研究中心的张国捷团队与丹麦哥本哈根大学、丹麦奥胡斯大学等国内外多家单位共同完成的题为 Evolution of the germline mutation rate across vertebrates 的论文7。研究人员对 68种脊椎动物151个家系,涵盖了36种哺乳动物、18种鸟类、8种辐鳍鱼类和6种爬行动物,共323个个体进行了高深度全基因组测序分析。并利用同一套生物信息分析策略,统一量化了脊椎动物类群中配系突变率的大小。研究发现不同物种每一代生殖细胞产生的突变率差异可达40倍。
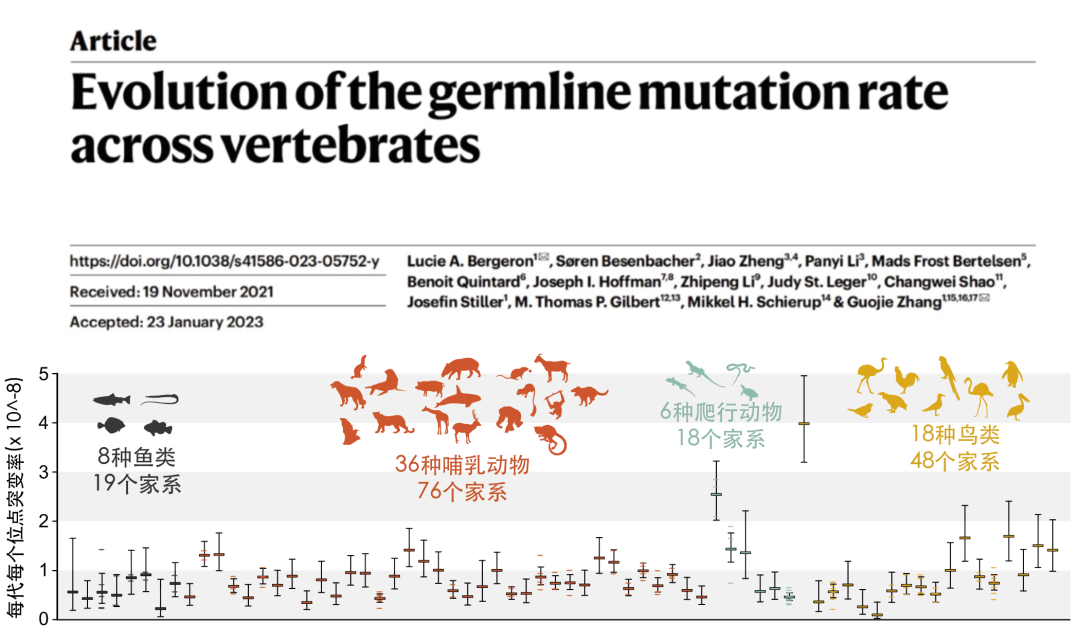
图3:生殖细胞突变率在68种脊椎动物中的差异分布
平均而言,爬行动物和鸟类每一代的胚系突变率要高于哺乳动物和鱼类。然而,这种差异在这四种脊椎动物类群之间并不显著。考虑到这些物种之间生活史特征的巨大差异,这表明脊椎动物具有比较相似的机制引发生殖细胞的DNA变异。
此外,样品收集是该项目的重点,也是难点之一。因为在野外生存的许多物种只有单亲抚育后代,且有些后代长到一定年龄后会离开巢穴独自生活,因此,收集野生物种的家系样品就变的非常困难。

鬃狮蜥,研究样品之一
研究团队通过与世界各地的动物园、动物博物馆、研究机构和养殖场建立合作,采集了许多珍惜的物种家系,为该项目的开展分析提供了可行性。

样品采集地的全球分布图
突变率高真的主要是雄性责任吗?
性别差异也是引发新生突变速率变化的重要原因。过去的研究发现随着父亲年龄增大,子代患有自发性先天性疾病和复杂疾病的风险会随之增加。例如当父亲年龄超过50岁,子代患有一些罕见单基因疾病,如软骨发育不全、Apert综合征、Crouzon综合征和多发性内分泌瘤的风险会增加约10倍,而引发这种高风险的大部分原因是由于精子形成过程中的新生突变所造成8。这种由于男性相对于女性生殖细胞会发生更多的细胞分裂次数,从而导致胚系突变率在同一物种不同性别之间出现的偏差称为雄性偏差,也称为雄性驱动演化假说。因此,为了详细探究在后代新产生的突变中,雌雄双方父母分别贡献了多少比例。研究人员对所有子代3,034个新生突变进行了父母染色体定位,大约48%的新生突变可以追溯到不同的亲本起源。进一步的分析表明,在鸟类后代中新出现的突变,大约75%是来自于雄性生殖细胞的变异,在哺乳动物中这一比例大约是67%。而在性别分化差异较低的鱼类和爬行类动物中,雌雄双方对后代新生变异的贡献接近一致
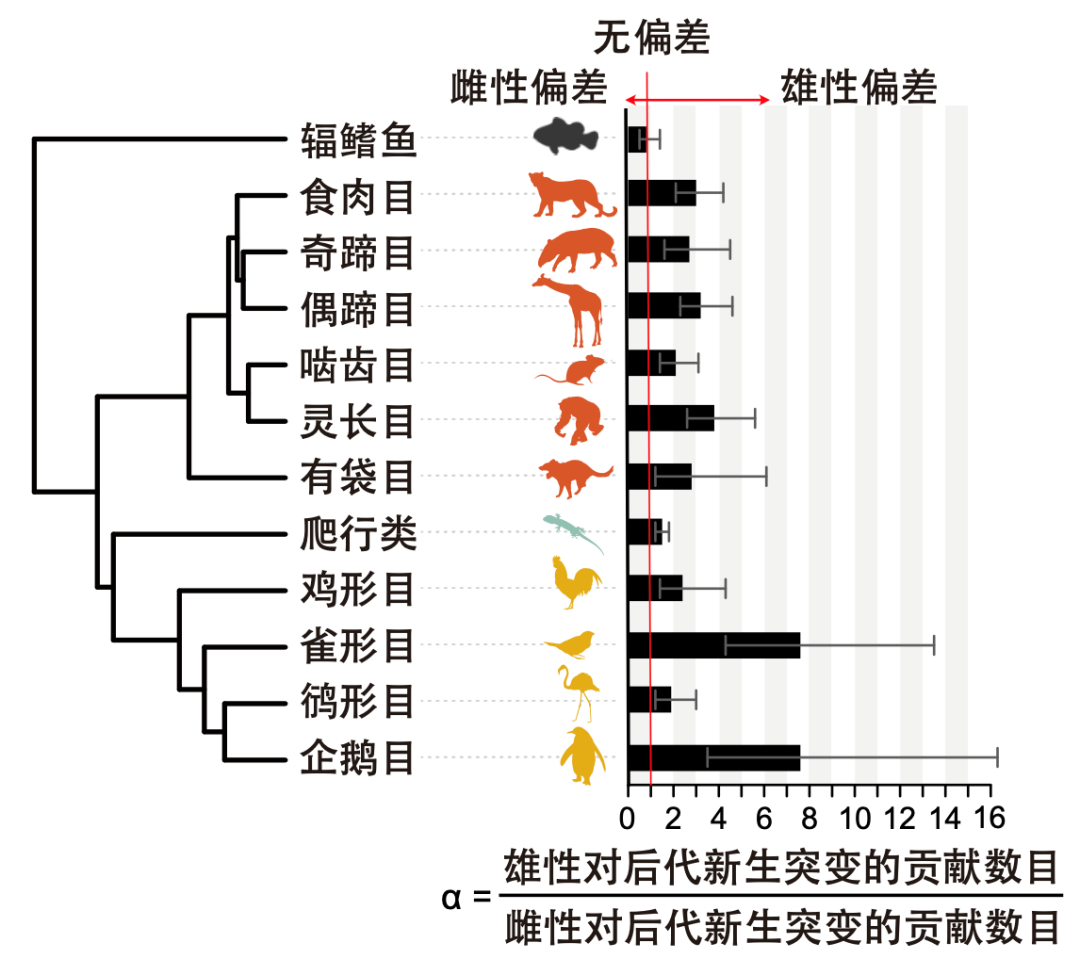
图6: 相对于鱼类和爬行类,在鸟类和哺乳动物后代的新生突变中,雄性的贡献比例远超雌性
突变速率变化的规律
物种间的突变率各异,其变化是否存在规律是研究突变率演化的重要问题。对于一个物种而言,如果其突变率需要保持在一定范围,那说明突变率本身如同物种其他生物学性状一样可以被稳定的遗传下来。为研究突变率与生物学性状特别是物种的生活史性状之间是否存在关联,研究人员收集了所有物种相关的生活史信息包括交配制度(一夫一妻制与一夫多妻制)、性成熟年龄、体重、寿命、繁殖力(每一代后代的数目)和世代时间等。所有这些特征在某种程度上都是可遗传的,因此受到自然选择的影响。结合物种的系统发生关系,研究人员分别测试了每代新生突变速率与不同生活史特征之间的关系。研究结果发现当世代时间越长,性成熟年龄越大,则每代积累的新生突变数目就会越多。
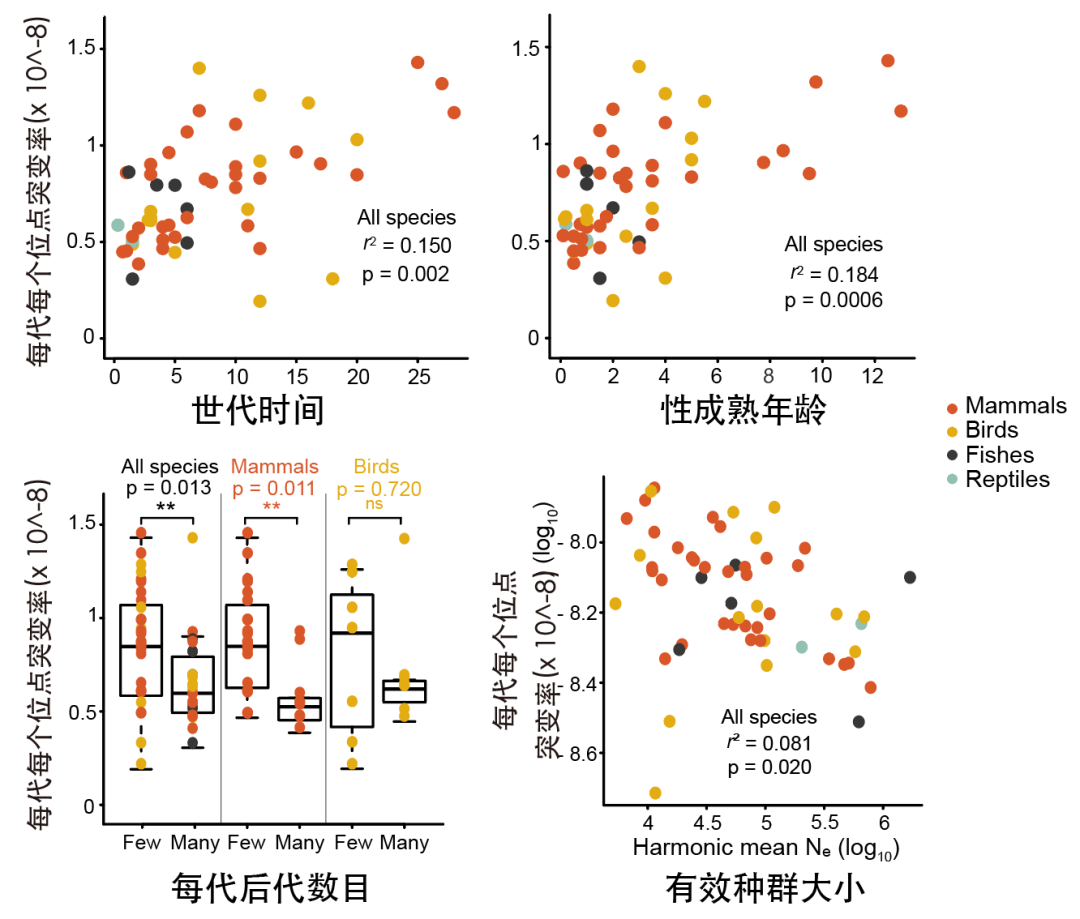
图7:不同生活史特征和新生突变率之间的关联
由于每代胚系突变率与每年胚系突变率为负相关关系,因此该结论支持世代时间所提出的假说。而每一代拥有更多“子嗣”的哺乳动物,其表现出较低的胚系突变率,但这一结果在鸟类中并不明显。此外,有效种群大小也是物种演化过程中的关键参数,其对自然选择和遗传漂变均产生影响。研究人员将该特征与物种胚系突变率相关联,证明当物种有效种群数目越大,每一代新突变的产生速率就越低,该结果为漂变屏障假说提供了重要证据。
突变率研究对医学领域的重要性
在人类正常细胞中,DNA复制具有极高的保真度。但这一准则在有些细胞中却未得到遵守。一些突变发生在生殖细胞中则常常与一些神经发育疾病有关,包括智力障碍、自闭症和精神分裂症等。例如在正常人群中大于100 kb的新生拷贝数变异并不常见,但是相比之下,在智力障碍、自闭症或精神分裂症的所有患者中,大约10%的患者出现了这些大规模的新生拷贝数变异。而最近通过全外显子组测序研究表明,基因中的新生胚系单核苷酸变异是诱发罕见散发性畸形综合征(如Schinzel-Giedion综合征、Kabuki综合征和Bohring-Opitz综合征)的主要原因。
此外体细胞的复制也会不断累积DNA突变,在失序的情况下会导致癌症发生。而突变率增加是人类癌症的一个典型特征,包括DNA损伤修复和DNA复制在内的几种细胞通路的异常,都可以诱导增加肿瘤细胞的突变率。通过对癌症突变模式和基因组表观特征的关联性研究,可以预测肿瘤细胞的起源,这对于主要位置未知的转移性肿瘤研究尤其重要并为后续疾病的治疗干预提供有效的靶向位点。此外,特异突变信号的出现可作为判断细胞癌化的风向标,有助于人类在早期发现并控制癌症,从而大大降低癌症诱发的死亡率。据GLOBOCAN 2020年估计,2020年全球有19,292,789例癌症病例和9,958,133例癌症死亡,是导致中国和发达国家疾病死亡的主要原因9。因此,通过揭示突变的诱发原因,以及突变在癌症发展过程中的作用和不同癌症之间的关联特征,对理解癌症的病因、预防、治疗以及人类长寿具有重要意义。
参考文献
1. Sturtevant, A. H. Essays on Evolution. I. On the Effects of Selection on Mutation Rate. The Quarterly Review of Biology 12, 464-467 (1937).
2. Zhang, G. The mutation rate as an evolving trait. Nature Reviews Genetics 24, 3-3 (2023).
3. Bergeron, L. A. et al. The Mutationathon highlights the importance of reaching standardization in estimates of pedigree-based germline mutation rates. eLife 11, e73577 (2022).
4. Haldane, J. B. The mutation rate of the gene for haemophilia, and its segregation ratios in males and females. Ann Eugen 13, 262-271 (1947).
5. Martin, A. P. & Palumbi, S. R. Body size, metabolic rate, generation time, and the molecular clock. Proc Natl Acad Sci U S A 90, 4087-4091 (1993).
6. Keightley, P. D. & Caballero, A. Genomic mutation rates for lifetime reproductive output and lifespan in Caenorhabditis elegans. Proc Natl Acad Sci U S A 94, 3823-3827 (1997).
7. Bergeron, L. A. et al. Evolution of the germline mutation rate across vertebrates. Nature (2023).
8. Toriello, H. V. & Meck, J. M. Statement on guidance for genetic counseling in advanced paternal age. Genet Med 10, 457-460 (2008).
9. Sung, H. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 71, 209-249 (2021).










