微染色体的演化之路
染色体作为位于细胞核内的遗传物质的基本单位,在整个真核生物进化过程中经历了广泛的变化。现存物种的染色体数量和大小差异巨大 (Fig. 1a)。在大多数鸟类和非鸟类爬行动物中,染色体可以表征为大尺寸的大染色体和小尺寸的微染色体 (Fig. 1b) (Burt 2002; Olmo 2008)。微染色体也存在于其他一些脊椎动物物种 (例如鱼类) 中,但通常不存在于两栖动物或哺乳动物中。大多数鸟类的核型非常保守,由9到10对大染色体和大约30对微染色体组成 (Srikulnath et al. 2015; Degrandi et al. 2020)。
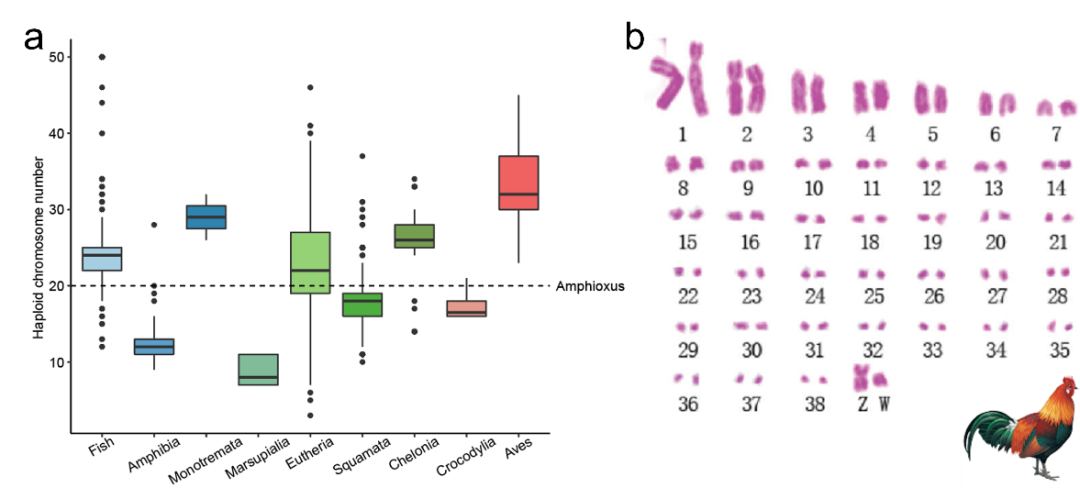
Fig. 1. Microchro a) The chromosome number of vertebrate species; b) The chicken karyotype with nine macrochromosomes and 30 microchromosomes.
保守的微染色体
早期的细胞遗传学研究认为鸡的大多数微染色体都属于单独的祖先连锁群 (Burt 2002)。比较鸡和雀鲷 (spotted gar fish) 的基因组发现,雀鲷的一半染色体 (14/29, 主要包括微染色体) 与鸡染色体显示出一对一的共线性 (Braasch et al. 2016)。这种一对一的共线保守性甚至可以追溯到非脊椎动物文昌鱼 (Branchiostoma floridae)的一些染色体中 (Simakov et al. 2020)。最近的一些研究重构了原始有颌类动物的祖先染色体 (N=45~46),表明两次全基因组复制 (2R WGD) 和随后亚基因组的非对称基因丢失最终塑造了微染色体 (Nakatani et al. 2021; Xu et al. 2022)。同样的,基于全基因组比对重构出的祖先基因组表明典型的‘avian-like’染色体核型 (10对大染色体和30对微染色体)从2.5多亿年前双孔亚纲 (Diapsida)祖先就已存在,并且一直在大多数现代鸟类中保持 (O’Connor et al. 2018)。笔者本人所在的团队有幸进一步补全了从bony vertebrate到爬行动物祖先这一阶段微染色体的变化,同样发现重构出的羊膜动物的祖先 (amniote)拥有与鸡高度相似的染色体构成。在非鸟的爬行动物中,龟鳖保持相对最为完整的微染色体,鳄鱼和蛇蜥等经历了大量的染色体融合,但依然存在微染色体 (由祖先微染色体融合而来);而祖先微染色体在哺乳动物中基本都融合到了大染色体,不再有独立的微染色体存在 (Fig. 2)。有趣的是,我们发现哺乳动物的祖先染色体依然保有微染色体。
读到这,大家自然而然会好奇,为什么鸟的微染色体这么保守?实际上在鸟内部,一些支系比如猛禽类和鹦鹉经历了大量的染色体重排,导致其微染色体的数量锐减 (Huang et al. 2022)。研究进一步发现可能是由于鹦鹉基因组丢失了两个与DNA双链修复和维持基因组稳定性有关的重要基因 (ALC1 and PARP3),这一结果为研究染色体重排机制提供了一个新的角度。那微染色体本身特别在鸟内是否有一些特质促进其高度保守性呢?
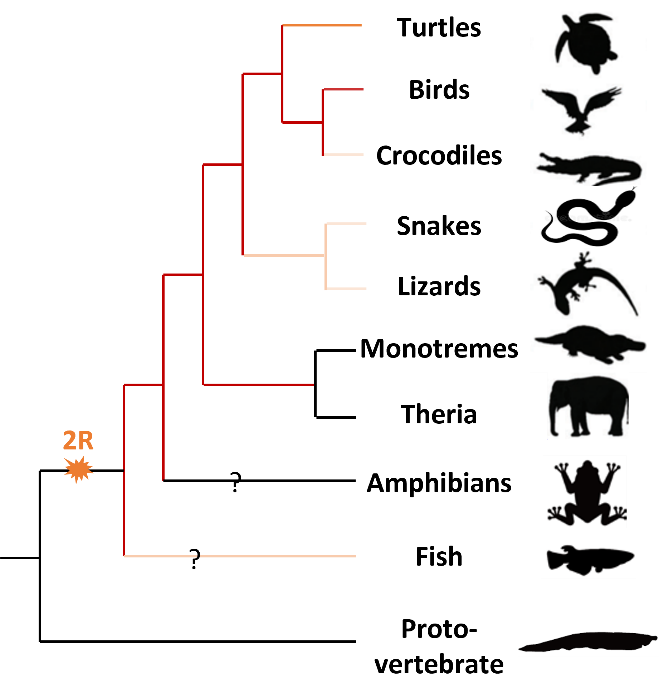
Fig. 2. Microchromosome existence across the vertebrate phylogenetic tree. Red color represents numerous microchromosomes; light orange color represents fused microchromosomes; ‘?’ represents unknown ancestral chromosome information.
微染色体的遗传特征
相比于大染色体,除了size的差异,微染色体表现出许多不同的基因组特征,包括更高的GC含量、更高的基因密度、更低密度的重复序列和更高的重组率等。尽管在许多两栖动物和鱼类中并未观察到这一点,染色体size负相关于GC含量的模式似乎是具有微染色体的鸟类和非鸟类爬行动物的普遍特征,表明其可能遗传自爬行动物甚至羊膜动物祖先 (Zhang et al. 2006; Matsubara et al. 2012; Li and Du 2014; Piovesan et al. 2019)。相比之下,哺乳动物可能由于染色体重排和转座元件 (TE) 的大规模增殖而失去了这一特征。一个经典的例子是,人类的18和19号染色体具有相似的大小,但在GC含量和基因密度方面表现出很大差异 (Cremer and Cremer 2001)。鸟类比较基因组研究表明,与鳄鱼和海龟基因组相比,鸟类丢失了118个大的共线性区域 (Zhang et al. 2014),其中大部分位于微染色体上,这意味着更高的GC含量可能导致鸟类微染色体进一步的序列丢失。
当然,序列GC含量的高低更可能只是表象,其和染色体大小之间的相关性应该通过重组率来解释。通常,GC含量越高,重组率越高。在鸟类中,微染色体的重组率 (中值为6.4 cM/Mb)远高于大染色体 (2.8 cM/Mb)(Rodionov et al. 1992; Li et al. 2021)。高重组率意味着微染色体对有害的重复序列的负选择消除更加高效(Charlesworth et al. 1986; McVean 2010),这将进一步导致GC含量/基因密度的升高,也使得通过重复序列间的非同源重组导致染色体间重排的几率下降。与此同时,高重组率往往也会导致微染色体拥有更高比例的进化断点区域 (Evolutionary breakpoint regions; EBR)。许多证据证明EBR与基因表达调控和物种特异性适应性表型相关 (Wind et al. 2005; Zhang et al. 2014; Farré et al. 2016)。总之,从双孔亚纲共同祖先到现代鸟类,微染色体的演化过程的特点是染色体之间的重排少,而染色体内重排多 (O'Connor et al. 2018; Damas et al. 2018),这可能是选择和重组的共同作用。
微染色体独特的空间排布
在鸡中,间期鸡成纤维细胞和神经元细胞核的细胞学研究发现微染色体主要聚集在核中心,大染色体倾向于位于核外围附近 (Habermann et al. 2001; Federico et al. 2005),而这种定位可能与染色体的基因密度相关。在两栖动物和爬行动物 (Federico et al. 2006) 以及许多脊椎动物 (Jabbari and Bernardi 2004) 中的原位杂交分析表明,gene-poor区位于细胞核的外围,gene-rich区占据中心位置。最近对几种羊膜动物的三维空间交互数据 (Hi-C) 的分析 (Fishman et al. 2019; Schield et al. 2019; Perry et al. 2021) 也进一步证实了这种典型染色体空间排布,即微染色体往往表现出更高水平的染色体间的相互作用。事实上,大小染色体的空间分布可能是由基因组和表观修饰的综合作用引起的。具有高基因密度的微染色体在S期最早期复制并高度乙酰化 (McQueen et al. 1998; Grützner et al. 2001)。相比之下,大染色体拥有更高比例的gene-poor和复制较晚的异染色质携带与核膜的结合位点 (AT-rich) (Pyrpasopoulou et al. 1996),形成核膜相关结构域 (LAD)的异染色质富集 (Fedorova and Zink 2008)。这种将基因密集和早期复制的开发染色质排布到核中心位置的空间结构,可以使它们远离核外围异染色质的沉默环境 (Schermelleh et al. 2001; Sexton et al. 2007)。另一个可能的解释是微染色体上基因调控网络的必要性 (Schield et al. 2019)。进一步的Hi-C分析表明微染色体具有更高比例的active compartment,代表活跃和开放的染色质,暗示聚集在核内部的active compartment具有功能一致性。
考虑到脊椎动物的祖先的核型与鸟 (鸡)高度相似,这种染色体的空间构象很可能也相当保守。我们也怀疑,这种空间排布的保守性与染色体核型的保守性应该是相辅相成的。
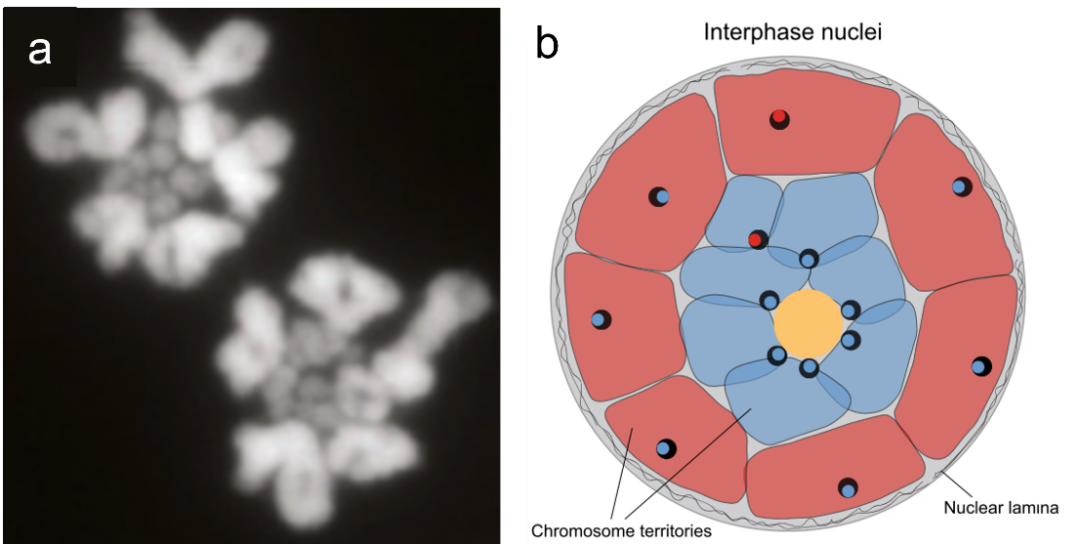
Fig. 3. a) Polar view of diakinesis in bearded dragon spermatocyte, showing different spatial location of macro and micro-chromosomes (Waters et al. 2021); b) Model of spatial location of macro (red) and micro-chromosomes (blue) in emu (Liu et al. 2021).
回到开始的问题,为什么鸟的微染色体如此保守?仅在羊膜动物内考虑,为什么非鸟类爬行动物和哺乳动物的微染色体不再保守?个人的一个猜测是非鸟类的羊膜动物可能经历了更严重的遗传漂变导致染色体的重排没有被选择消除反而固定下来,重排后的微染色体序列无法继续保持高GC/重组率的特征。另一个相对更有说服力的假设是鸟类的飞行能力带来的高代谢率促使更小的细胞和基因组size (Ji et al. 2017),而后者往往通过缩减内含子和转座元件的数量来实现,正如我们在微染色体中看到的情况。而保持独立且小size的微染色体可以保证高GC/重组率,这可能是鸟内需要维持微染色体的可能原因。当然这一假设也在被多个现象中挑战,比如猛禽鸟类的大规模染色体重排,丢失飞行能力的古颚类鸟 (如鸵鸟和鸸鹋)也具有相当保守的微染色体。所以,你觉得为什么大多数鸟的微染色体这么保守呢?不论如何,大家嘴里正在啃的鸡腿大抵是缩小版的恐龙腿。(该文仅代表个人观点,欢迎讨论)
参考文献
1. Braasch, I., et al., The spotted gar genome illuminates vertebrate evolution and facilitates human-teleost comparisons. Nat. Genet., 2016. 48(4): p. 427-437.
2. Nakatani, Y., et al., Reconstruction of proto-vertebrate, proto-cyclostome and proto-gnathostome genomes provides new insights into early vertebrate evolution. Nat. Commun., 2021. 12(1): p. 4489.
3. O'Connor, R.E., et al., Reconstruction of the diapsid ancestral genome permits chromosome evolution tracing in avian and non-avian dinosaurs. Nat. Commun., 2018. 9(1): p. 1883.
4. Cremer, T. and C. Cremer, Chromosome territories, nuclear architecture and gene regulation in mammalian cells. Nat. Rev. Genet., 2001. 2(4): p. 292-301.
5. Zhang, G., et al., Comparative genomics reveals insights into avian genome evolution and adaptation. Science, 2014. 346(6215): p. 1311-1320.
6. Habermann, F.A., et al., Arrangements of macro- and microchromosomes in chicken cells. Chromosome Res., 2001. 9(7): p. 569-584.
7. Waters, P.D., et al., Microchromosomes are building blocks of bird, reptile and mammal chromosomes. Proc. Natl. Acad. Sci. U. S. A., 118.45 (2021): e2112494118.
8. Natalie A., W., et al. Metabolic ‘engines’ of flight drive genome size reduction in birds. Proc. Royal Soc. B., 281.1779 (2014): 20132780.










