生命演化的八大“变形记”:从简单到复杂的漫长之旅
无论你是否正在从事生命科学研究,这个问题或许都曾在脑海中一闪而过:地球上的生命是如何从微小的单细胞生物一步步演化出如今包括复杂的人类社会在内的丰富多彩,形态各异的各种生物体?从亚马逊雨林中茂密的植被到大堡礁中色彩斑斓的海洋生物,这一切生机勃勃的背后,是什么力量在背后推动着生命演化?当我们探寻化石记录,试图找出那些改变历史的重大事件时,也许会关注到最早能够爬上陆地的鱼类记录,或是那些像我们一样用两条腿行走的早期猿类。但这些演化的标志性事件都只是表面上的变化,代表的仅仅是形态结构和生存方式的转变,而不能代表生物体复杂性的大幅跃升。为了真正了解演化中的巨大飞跃——人们称之为“重大演化转变”——我们必须回溯得更远,深入到生命如何逐步迈向新的组成形式以实现复杂度的跃迁。

图1 生命演化的历程:从简单分子到复杂生命
翻译自《大英百科全书》
(©Encyclopaedia Britannica, Inc.)
英国著名演化生物学家约翰·梅纳德·史密斯(John Maynard Smith)早在三十年前就深入探讨过这个问题。他在与学生厄尔斯·萨撒玛里(Eörs Szathmáry)合著的《The Major Transitions in Evolution》(《生命演化的关键转折点》)中,提出漫长的演化过程中,生命经历了一系列关键的重大演化转变(Major evolution transition,MET)促使生命的组成形式变的更加复杂。1999年,也就是发表的四年后,他们以更简洁易懂的文字重写并以《THE ORIGINS OF LIFE. From the Birth of Life to the Origin of Language》(《生命的起源-从生命的诞生到语言的起源》)为题再版了他们的观点。从此,这本书解答了更多人的疑问,深刻影响了演化生物学的研究方向,至今仍被视为探讨演化生物学和遗传学的经典著作。
这本书的核心内容是揭示生命在地球上从简单分子演化出复杂形式的一系列关键步骤。重大演化转变是指演化过程中发生的关键性变化,这些变化导致了新的生物组织层次的形成。在这里,我们仍然要强调,虽然我们常常认为演化史上发生过非常多个重要的演化事件,但它们并不都足以称为重大转变。Maynard Smith 和 Szathmáry提出了两种主要标准来定义 MET。第一个是涉及“信息存储和传输方式的改变”,例如从 RNA 到 DNA 的转变。第二种标准则强调,从一组较低级别的单元中形成一个新的、更高级别的生物单元1,2(图3)。由此,以此为标准,他们提出生命演化史上共有八次重大转变1(图2),这些“转变”每次都让生命的复杂性和多样性达到一个新的层次。那么,这八大演化转变到底是什么呢?转变中具体发生了什么?转变的意义和最终目的是什么?接下来我们将对生命演化史中每一个关键转变进行深入探讨,这些转变犹如一系列巧妙的机关,不仅改变了生命本身,更是塑造了我们所知的整个地球生态系统,将简单的分子逐步演变成当今万物竞发的生物世界。

图2 八大重大演化转变

图3 一次重大演化转变的两个步骤2
首先是合作群体的形成,其次是向更高级别个体的转变,包括分工、相互依存以及各组成部分的协调。
Ⅰ
从独立复制分子到细胞
距今40亿年的早期地球上,RNA作为自身遗传编码分子的生命形式,被认为是地球上最早出现的第一种生命形式, 这被称为RNA世界假说3(Walter Gilbert, 1986)。随着时间的推移,这些分子逐渐被原始的膜结构包裹,形成了早期细胞样的结构,这个过程推动了生命从单纯的分子化学向生物学领域的转变。其中,一个关键的转折点是膜结构的形成。脂质体(liposome)是一种由双分子层脂质形成的囊泡,它能够将自我复制的RNA分子隔离在封闭的环境中(图4)。这样,RNA分子得以在相对稳定和保护的条件下进行复制,避免了外部环境的干扰,增加了其存活和繁衍的几率。这种封闭的区室为遗传信息的更稳定传递创造了条件。细胞膜的出现使得早期生命具备了更强的生存和适应能力,使生命开始具备了基本的细胞结构(现在也有很多人认为这是生命真正诞生的标志)。细胞不仅能够隔离和保护遗传物质,还能进行高效的自我复制和代谢,是生命开始复杂化的开端。

图4 RNA的形成和细胞膜的形成4
(图源Matthew Twombly)
Ⅱ
从分离的复制子到染色体
复制子,指任何能够自我复制并传递遗传信息的实体,例如基因或其他能够自我复制的分子结构5(Richard Dawkins, 1976),例如大肠杆菌的DNA、附加体(episome)、质粒等。遗传信息以独立分子形式进行复制存在一定限制,尤其是在遗传信息传递和保持稳定性方面。由于复制不准确,独立基因的复制容易出现较高的突变率,导致基因信息无法稳定传递。此外,独立的基因在细胞分裂过程中可能会丢失,使得子代细胞不能完整继承全部遗传信息。染色体的形成很好地解决了这一问题。首先,染色体将多个独立复制的基因连接在一起,确保在复制时,所有基因能够同时复制,避免了单个基因出错或丢失的风险。其次,在细胞分裂时,染色体的结构便于基因副本的均匀分配,确保每个子细胞都能获得完整的遗传信息。这样,染色体的形成不仅提高了遗传信息的复制效率,还大幅减少了突变的可能性,增强了生物体的适应能力。
现代细菌的环状染色体就是这种转变的一个例子。在原核生物中,基因通常集中在一个环状染色体上,这种结构有助于遗传信息的有效传递和稳定复制。此外,染色体的形成标志着遗传信息从简单到复杂的转变,这一过程允许更多的基因信息得以储存和传递,促成了更复杂生命形式的出现。这一转变之所以能够发生,是因为它解决了早期自我复制系统中的一些核心问题,包括遗传信息的稳定存储、传递以及减少突变的风险。这一转变在生物演化中具有重大意义,推动了生命从简单的分子系统向更复杂的形式发展。
Ⅲ
从作为基因和酶的RNA
到DNA和蛋白质
上面说到,最初的遗传物质和催化反应的酶都是RNA,而现如今大部分生命体的遗传信息的主要载体却是DNA,主要的催化剂和结构组件则是蛋白质。那么,为什么RNA要向DNA演化?酶又为何变成以蛋白质为主?这些转变是如何实现的呢?
在最早期,RNA不仅充当遗传物质,还具备催化功能,能够自我复制和执行生物化学反应。随着演化的进行,RNA逐渐发展出指导蛋白质合成的能力。蛋白质逐渐成为主要的催化分子,RNA的功能逐渐专门化,主要用于存储遗传信息并指导蛋白质的合成。从化学结构上看,RNA单链结构较容易降解。为了长期、稳定地储存大量的遗传信息,细胞逐渐演化出一套以逆转录酶为核心的逆转录系统,将RNA上的遗传信息转存到具有更为稳定、不易损坏的双螺旋结构DNA上(图5)。这套系统能以RNA能够作为模板,在其指导下合成DNA, 从而将遗传信息转录到DNA上,这为DNA逐步成为遗传物质的主要储存形式奠定基础。基因的连锁也是这一过程中重要的一环。逆转录酶的跳跃特性使得DNA分子能够将多个RNA模板的信息连接在一起,形成连锁的DNA分子,最终形成基因组。这种连锁确保了遗传信息在细胞分裂时能够稳定传递,并为细胞的稳定性提供了保障。随着连锁的分子越来越多,最终形成染色体,染色体通过细胞分裂稳定传递遗传信息。通过转录和翻译机制,RNA可以将DNA的遗传信息转化为蛋白质,蛋白质作为生物体内的功能性分子,比RNA具有更广泛的催化能力,执行了几乎所有重要的生命活动。此外,尽管DNA结构稳定,但仍有部分游离基因未整合入染色体,这些游离基因可能成为病毒等微生物的来源。

图5 从RNA世界逐步过渡到现代细胞的过程6
(©Garland Science 2010)
Ⅳ
从原核生物到真核生物
如今生机勃勃的复杂生态系统离不开17亿年前,地球生命经历的一次飞升般的蜕变——真核生物的起源。这一重大转变是一个多步骤过程,涉及一系列复杂且互相影响的变化。一个关键的步骤是失去细胞壁,使得细胞能够利用细胞膜进行更复杂的物质交换等。然而,这一看似简单的变化,实际上开启了一连串的重要演化事件7,8(图6)。首先,细胞壁的消失使得细胞可以通过吞噬固体颗粒来获取养分,从而改变了它的进食方式。同时,细胞必须演化出内部支架(即细胞骨架)和新的运动机制来适应这种变化。此外,细胞膜系统和细胞核膜的演化使得转录和翻译过程在空间上分离,这是一种提高效率和基因调控的演化改进。随着这些变化的发生,细胞染色体也演化出了多个复制起点,突破了基因组大小的限制,进而使得细胞能够携带更多的遗传信息。线粒体和质体等细胞器的出现标志着细胞内部分工的进一步细化,并且极大地提高了细胞的能量效率和光合作用能力。当然这些变化发生的先后至今仍有争议(图7),但不可否认的是它们都对真核细胞的形成至关重要。这些变化不仅改变了遗传信息的存储和传递方式,也为之后的生物复杂性奠定了基础。总之,真核生物的起源并非一个单一的事件,而是由多个密切相关的演化步骤组成的。这些步骤包括细胞结构、功能、遗传信息存储方式的重大变化,其中的关键事件如线粒体和叶绿体的起源,极大地改变了细胞内的能量代谢和遗传机制。(更详细的讨论可见科普文探索真核生命的起源之迷:一场演化生物学的壮丽征程)

图6 真核细胞形成的inside-out模型7
(A) 起源于一个具单一包膜且富含糖蛋白的细胞壁(S层)的祖先真核生物细胞(eocyte),它与外部共生的α-变形菌(原始线粒体)发生相互作用
(B) 通过蛋白质与膜的相互作用形成突出物 (C) 选择压力促使宿主与共生体之间的接触面积增大
(D) 突出物进一步通过对称核孔外环复合物的发展以及LINC复合物的建立得到稳定
(E) 宿主逐渐获取细菌的脂质生物合成机制,细胞生长的主要位置逐渐转移到胞质中
(F) 突出物的融合将胞质隔室连接在一起,并通过类似于吞噬作用的过程形成完整的质膜

图7 真核细胞形成不同假说的发生顺序7
Ran、Rab、Sar1 和 Rho,小GTP酶亚家族;LINC(Linker of Nucleoskeleton and Cytoskeleton),核骨架与细胞骨架连接蛋白;COPII(Coat protein II),外被蛋白II;SNAREs(SNAP Receptors,可溶性NSF附件蛋白受体;Nucleoporins,核孔蛋白;Dynamin,动力蛋白;Actin,肌动蛋白;myosin,肌球蛋白
Ⅴ
从无性克隆到有性群体
除了单个个体的复杂化, 演化过程中个体之间的关系也渐渐变得更加复杂, 其中个体代际传递的繁殖行为的复杂化——从无性克隆到有性生殖的转变, 具有非常重要的作用,被认为是八次重大转变之一。无性繁殖是早期许多简单生物的主要繁殖方式。在无性繁殖中,个体通过克隆产生与自身基因完全相同的后代,这使得繁殖过程非常高效和直接。而有性繁殖的物种在择偶和求偶的过程中需要耗费大量时间和资源,最终只有一半的基因遗传给后代,较之无性繁殖的物种损失了50%(图8)。既然如此,为什么还会发生从无性到有性繁殖的演化呢?

图8 甲藻(Gyrodinium fuscum)的无性繁殖和有性生殖
(© 2008 Pearson Benjamin Cummings)
最初有人认为,是由于同种细胞在某些特殊原因下发生了融合。理查德·道金斯在《自私的基因》中用演化博弈论的思想解释,大配子(即卵子)体积较大,含有更多养分,能够提供支持胚胎发育所需的资源,因此在生存概率上占据优势,小配子(即精子)体积较小,但数量多,易于扩散并增加受精概率,因此在传递遗传信息的效率上占优势,而中等大小的配子既没有足够的养分支持发育(与大配子相比劣势),也无法像小配子那样通过数量优势提高受精成功率,因此在演化博弈中处于劣势,逐渐被淘汰,由此形成了配子二型的稳定分化5。内共生学说认为,性别起源于同种细胞内的小个体被大个体吞噬并共同生存,小个体最初只是为了在被吞噬后存活下去,但随着时间的推移,它们开始为大个体提供遗传物质,最终形成类似精子的结构;大个体提供了一个稳定的环境,同时通过体积优势储存更多的营养,最终演化成类似卵子的结构8。也有人认为是恶劣环境导致了雌雄二型配子的发生。总之,最终配子的雌雄二型稳定下来。由于无性繁殖是自体演化,种群内没有基因交流,其后代之间的基因多样性极低,使得物种面对环境变化时缺乏适应性,容易因积累有害突变而导致种群衰退。而进行有性繁殖的生物的基因库更丰富,在环境发生改变时,基因库中基因频率可以在更少的世代更替中发生改变,迅速适应新环境。控制有性生殖的基因也在这样的基因流变中有更大的概率保存下来,最终导致了这些基因在基因库中的逐渐扩散。在这一演化过程中,性别的出现使得个体分化出专门的生殖细胞:雄性产生精子,负责移动寻找卵子;雌性产生卵子,储存养分并支持胚胎发育。随着性别的进一步分化,次级性别特征(如体型、颜色等)也开始演化出来,强化了配偶竞争并优化了繁殖行为。通过这些演化步骤,生物从无性繁殖的克隆个体,逐渐演化成有性繁殖的复杂群体,为自然选择提供了更广泛的选择基础。(但性别并不一定是稳定的,更多关于性别的起源与演化可见科普文不只是雌雄:性别的起源和流动)
Ⅵ
从单细胞生物到多细胞生物
除了繁殖以外,个体关系的复杂化中共生(Symbiosis)关系的复杂化也具有十分重要的作用。在单细胞生物中,共生是常见的演化策略,它可以为双方提供生存优势。例如,某些单细胞的蓝藻和真菌之间形成地衣,共同对抗不利的环境。这种关系往往是长期稳定的,促使生物相互依赖。单细胞生物通过功能分化与协作,实现了类似共生的生存优势,如资源共享与代谢互补等。在演化过程中,这种内部的功能分化逐渐发展为更加紧密的协作模式,使生物群体表现出更高层次的协作性和适应性(图9)。随着时间推移,这种合作关系逐渐走向稳定,细胞之间开始产生功能分工,并最终演化为真正的多细胞结构。多细胞生物的形成标志着细胞间相互依赖性的高度整合,使得单个细胞无法独立生存,必须作为整体的一部分共同繁衍生息。这种高度整合使得群体的适应性大大提高,形成了今天复杂的多细胞生物,如植物、动物和真菌。
细胞间的高度分工需要一种似乎应该不太常见的特性——细胞的无私性(例如细胞需要自愿牺牲自我的繁殖能力以促进整体繁殖的成功)。事实上,目前地球上的单细胞生命仍然远多于多细胞生命。那么,单细胞生物真的会甘愿为了集体利益牺牲自己的利益,转而成为更复杂的多细胞生命吗?
尽管演化通常是一个缓慢的过程,且从单细胞到多细胞的演化发生在多年以前,但我们现在已经可以用实验室演化(Experimental Evolution)模拟不同环境下的生物演化过程9,帮助揭示多细胞演化的奥秘。1998年,Boraas及其团队进行了一个实验,展示了藻类的多细胞演化过程。在这个实验中,研究人员发现在小型捕食性原生生物(Ochromonas vallescia)的捕食压力下,单细胞藻类Chlorella vulgaris在不到20代的时间里演化成了多细胞团簇,这些团簇大到足够避免被原生生物吞食10。在捕食压力下,Chlamydomonas reinhardtii可以从单细胞逐步演化为复杂的多细胞形式11(图10)。这表明环境压力(例如捕食者的存在)可能在推动多细胞性的演化中起到了关键作用。最近,佐治亚理工学院的William Ratcliff团队发现,当雪花酵母(Saccharomyces cerevisiae)被置于有利于多细胞形式的条件下时,酵母在短短60天内就能演化为多细胞团簇12,13(图11)。以上实验都展示了单细胞祖先到多细胞生物的演化过程,说明在适当的定向选择压力下,多细胞性可以快速演化,也让我们对多细胞合作的演化机制有了更深入的理解。(如对实验演化感兴趣,可阅读科普文实验演化——为演化按下“快进键”)

图9 以共生为基础的生命紧密合作方式
(© Stated Clearly)

图10 Chlamydomonas reinhardtii在有捕食者(B2, B5)或无捕食者(K1)的环境下经过50周演化后表现出不同形式11
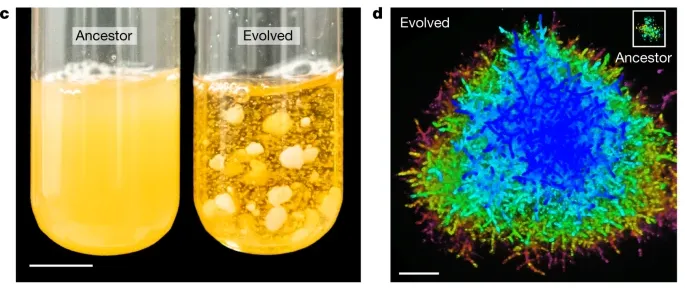
图11 雪花酵母性格、尺寸显著变化12
Ⅶ
从独居个体到社会群体
个体间关系的进一步复杂化是从独居个体到社会的形成。这一转变在演化历史上发生过许多次,每一次都是独立的重要演化事件。我们首先要讨论的是真社会性群体,其特征包括世代重叠、生殖分工、合作育幼,也就是说不具有生殖能力的个体也会参与对群体中幼体的照顾。典型的真社会性昆虫群落有蚂蚁、蜜蜂、黄蜂和白蚁及一些海洋无脊椎动物组成的群落,它们由专门负责不同角色的个体组成。需要强调的是真社会性昆虫社会群体中的不同类型个体在基因组上都是相同的:例如,蚁群中的蚁后、工蚁和雄蚁等,它们的不同分工不是由基因差异导致的,而是因为相同基因型对不同社会环境的反应(图12)。那么我们需要回答的问题就是,具有相同基因型的幼体是如何发育成具有不同分工的个体的呢?

图12 蚁群超个体示意图
(部分图源14)
社会性昆虫中非繁殖性的品级,即所谓的工蜂、工蚁等,被达尔文认为是对其提出的以个体竞争为基础的自然选择学说的一个严峻挑战。一般认为,繁衍后代是生物体在基因层面上的基本驱动力,是自然选择作用下生物体得以延续和演化的关键,为什么有些个体会放弃传递自己的基因?要回答这个问题,我们可以参考达尔文和J.B.S.霍尔丹在1955年的观点。达尔文曾暗示,如果受到选择的单位是家庭而不是个体,那么他的理论就可以成立。霍尔丹则进一步强调了这一观点,他在解释亲缘选择的理论时说自己甚至愿意为保持两个兄弟或十个表亲献出生命,理由是这些亲属平均共享了他一半或八分之一的基因。这个基本想法在1960年代被威廉·D·汉密尔顿进一步发展为一个关于动物社会的普遍理论,即广义适合度理论(inclusive fitness theory)15–17(Hamilton, 1963)。当分工合作的对象成为了真正意义上的个体,群体内个体或个体群体在追求自身适应性(inclusive fitness)最大化时,由于不同个体的适应性最优解不一致,就会发生利益冲突,进而产生竞争或对抗。这种冲突在演化层面表现为生殖竞争或分工冲突。尽管这样的冲突普遍存在,群体演化中的重大转变之所以能够稳定发生,是因为出现了有效的冲突解决机制18。广义适合度理论论通过解释个体如何在群体中平衡直接适应性(自己繁殖后代)与间接适应性(通过帮助亲属繁殖后代)来帮助理解这些冲突。例如,在真社会昆虫中,工蜂之间通过“工蜂警戒”(worker policing)来限制彼此的繁殖行为18(例如,工蜂会摧毁由其他工蜂产下的卵,只允许由蜂王产下的卵继续发育),这样解决了潜在的冲突,从而减少了生产力的损失。这种机制不仅帮助维持了群体的稳定,也促进了群体内个体的进一步演化和发展。(更多关于真社会性演化机制的讨论,可见科普文帝国崛起----蚂蚁社会的形成)

图13 广义适合度理论19,20
包容性适合度是直接适合度和间接适合度的总和。社会行为不仅影响个体自身的繁殖成功,还会影响其他个体的繁殖成功。对行为者自己繁殖成功的影响称为直接适合度效应,而对社会伙伴的繁殖成功产生的影响,按行为者与受益者的亲缘关系加权,则是间接适合度效应。需要注意的是,包容性适合度并不包括亲属的所有繁殖成功,只包括因行为者的行为所产生的那部分(图中黄色)。同时,包容性适合度也不包括由于行为者的社会伙伴行为而导致的行为者自身的繁殖成功(图中紫色)。
Ⅷ
从灵长类社会到人类社会
最后,让我们将视线聚焦于另一种重要的社会群体,即人类社会。人类区别于真社会性昆虫群体的最重要特征是对个体的识别,昆虫可以识别群体成员,但它们不能识别个体。相比之下,灵长类动物将其群体中的其他成员视为个体,并以不同的方式对待他们,并且,群体内的社会互动就依赖于这种对个体的识别。也就是说,社会智力是灵长类动物的共同特征。在灵长类动物中, 人类与其他动物相比, 其中最大的区别在于每个人都有自己的信仰、知识体系、技能特长等,这些都不是单纯通过基因遗传获得的,但却是决定个体在人类社会中的角色的关键。那么,人类独有特质是如何起源演化的呢?
人类独有特质产生的物质基础无疑是一个发达的大脑。最新的研究成果发现,灵长类动物与其他动物相比已经出现了明显的变化,不仅变得更大,其大脑皮层的折叠程度也显著提高,这使得它们能够处理更加复杂的认知任务,适应社会生活。这一转变的发生与一系列基因的正向选择和非编码区域DNA序列的加速演化密切相关21。大脑的这些变化让灵长类动物能够更好地解决问题、进行社交互动。这也意味着,人类社会的形成还需要因素的参与,有科学家认为,对人类社会的形成至关重要的另一因素为复杂的语言和文化系统。1985年,由罗伯特·博伊德(Robert Boyd)和彼得·里切森(Peter Richerson)提出的文化演化理论解释了人类的行为和文化特征如何通过类生物演化的过程被遗传和传播,这为理解人类社会和语言的演化奠定了基础。正如诺姆·乔姆斯基(Noam Chomsky)所说:“人类有一种特殊的语言器官。”语言的起源被视为最后一次重大的演化转折,其同样涉及遗传信息的改变22。(对灵长类动物起源和演化的研究和更多解读可见系列科普文8篇Science齐发 | 生命演化研究中心张国捷团队联合中外科学家破译灵长类生命天书及远古的足迹:从猿类视角追踪人类表型演化的秘密)
纵观生命演化历史上的这八个重大转折,不难发现其共同特征:
(1)在转折之前能够独立复制的实体,在转折之后只能作为更大单位的一部分进行复制。例如,自由生活的单细胞生物最终成为多细胞生物基本结构单元。
(2)演化在自然选择的作用下是缺乏“远见”的,即我们不能简单地用它们带来的最终利益来解释这些转折,因为最终目的并不是最初转变的催化剂。
(3)信息存储和传递发生了变化,这种变化具有不可逆性。例如,遗传密码的起源和转变、有性繁殖的起源以及人类语言的起源等。
从最简单的分子到人类社会,生命在地球上的演化就像是一幅不断展开的宏伟画卷。这些主要演化转变是生物复杂性的逐步增加的体现,更是生物如何在不同环境和挑战中演化出新的生存策略的关键。事实上,由于演化过程无法复现,我们目前对这些演化重大转变的理解仍然是有限、不完全的,转变发生的原因很多都只是假说而非已经被完全证实。我们对重大演化转变的探索当然不止于此,只有继续深入才得以更好地解释生命的多样性和复杂性,以及预测未来的演化趋势。
人物故事
约翰·梅纳德·史密斯
John Maynard Smith

巧的是,史密斯本人的一生也在职业道路上经历了重大转变,他最初是一名航空工程师,在设计飞机的过程中发现自己更迷恋生命的奥秘。于是,他果断转行,投身到生物学的怀抱,师从生物学家霍尔丹(J. B. S. Haldane)。他俩的缘分要从他15岁时读霍尔丹的散文集《Possible Worlds》说起,他们都擅长发现具有生物学意义的理论问题,喜欢用简单的数学模型来阐明具体的生物学问题,不断探索和发现,最终成为了最有影响力的演化生物学家之一。而他其实并未获得博士学位,因为他很快就以出色的能力获为了UCL动物学系的教职。史密斯用他传奇的一生证明,追随自己的好奇心会引领我们进入一个全新的、广阔的世界。
参考文献:
1. Maynard Smith, J. & Szathmary, E. The Major Transitions in Evolution. (Oxford University Press, 1997). doi:10.1093/oso/9780198502944.001.0001.
2. West, S. A., Fisher, R. M., Gardner, A. & Kiers, E. T. Major evolutionary transitions in individuality. Proceedings of the National Academy of Sciences 112, 10112–10119 (2015).
3. Gilbert, W. Origin of life: The RNA world. Nature 319, 618–618 (1986).
4. Szostak, J. How Did Life Begin? Nature 557, S13–S15 (2018).
5. Dawkins, R. The Selfish Gene. (Oxford university press, 2016).
6. Alberts, B. et al. The RNA World and the Origins of Life. in Molecular Biology of the Cell. 4th edition (Garland Science, 2002).
7. Baum, D. A. & Baum, B. An inside-out origin for the eukaryotic cell. BMC Biology 12, 76 (2014).
8. Sagan, L. On the origin of mitosing cells. Journal of Theoretical Biology 14, 225-IN6 (1967).
9. Miller, S. M. Volvox, Chlamydomonas, and the Evolution of Multicellularity. Nature Education 3, 65 (2010).
10. Boraas, M. E., Seale, D. B. & Boxhorn, J. E. Phagotrophy by a flagellate selects for colonial prey: A possible origin of multicellularity. Evolutionary Ecology 12, 153–164 (1998).
11. Herron, M. D. et al. De novo origins of multicellularity in response to predation. Sci Rep 9, 2328 (2019).
12. Bozdag, G. O. et al. De novo evolution of macroscopic multicellularity. Nature 617, 747–754 (2023).
13. Ratcliff, W. C., Fankhauser, J. D., Rogers, D. W., Greig, D. & Travisano, M. Origins of multicellular evolvability in snowflake yeast. Nat Commun 6, 6102 (2015).
14. Li, Q. et al. A single-cell transcriptomic atlas tracking the neural basis of division of labour in an ant superorganism. Nat Ecol Evol 6, 1191–1204 (2022).
15. Smith, J. M. Group selection and kin selection. Nature 201, 1145–1147 (1964).
16. Hamilton, W. D. The genetical evolution of social behaviour. I. Journal of Theoretical Biology 7, 1–16 (1964).
17. Hamilton, W. D. The genetical evolution of social behaviour. II. Journal of Theoretical Biology 7, 17–52 (1964).
18. Bourke, A. F. G. Conflict and conflict resolution in the major transitions. Proceedings of the Royal Society B: Biological Sciences 290, 20231420 (2023).
19. Gardner, A. & West, S. A. Demography, altruism, and the benefits of budding. Journal of Evolutionary Biology 19, 1707–1716 (2006).
20. West, S. A., Griffin, A. S. & Gardner, A. Evolutionary Explanations for Cooperation. Current Biology 17, R661–R672 (2007).
21. Shao, Y. et al. Phylogenomic analyses provide insights into primate evolution. Science 380, 913–924 (2023).
22. Richerson, P. J. & Boyd, R. Not by Genes Alone: How Culture Transformed Human Evolution. (University of Chicago press, 2008).










